
【题目】某实验小组同学在探究Fe、Fe3+、Ag+相互间的反应时,设计了如下系列实验。已知: Ag+与SCN- 生成白色沉淀AgSCN。请按要求回答下列问题。
他们先向硝酸酸化的0.05mol/L AgNO3溶液(pH≈2) 中加入稍过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色; 经检验未生成其他含氮物质.
(1)由“黑色固体”,甲猜测固体中含有Ag; 他取出少量黑色固体,洗涤后放入试管中,后续操作是_______,发现有白色沉淀产生。
(2)乙取上层清液于试管中,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。由此得出Fe与Ag+间发生的离子反应之一为___________。
(3)由“溶液呈黄色”,丙猜测溶液中有Fe3+; 而丁认为在铁粉稍过量充分反应后的溶液中不可能合有Fe3+,其理由是(用离子方程式表示):________。
丙为证实自己的猜测,取上层清液,滴加_______,溶液变红,同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
①“白色沉淀”是_________。
②丙对Fe3+产生的原因分析:
因“未生成其他含氮物质”,故认为Fe2+不是被________氧化的。随后又提出了如下假设:
假设a:可能是铁粉表面有氧化层,与H+反应生成Fe3+;
假设b:Fe2+被O2氧化,而产生Fe3+;其对应的高子反应方程式为_________
假设c:__________氧化了Fe2+,而产生Fe3+
③丙为证实假设a、b不是主要原因,又补充了对比实验: 向硝酸酸化的(pH=2)_____中加入过量铁粉,搅拌后静置,不同时间取上层清液清加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
④戊为证实上述假设c成立,设计了如右图所示装置:分别取此电池工作前与工作-段时间电源计指针回至“0”时左池中的溶液,同时分别滴加K3[FeCN)6]溶液,后者蓝色沉淀较少;左池再滴加X的浓溶液,指针又有偏转。则X为________溶液;该电池总反应的离子方程式为:__________。
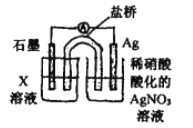
【答案】 加硝酸,微热,溶解固体,再滴加稀盐酸 Fe+2Ag+=Fe2++2Ag Fe+2Fe3+=3Fe2+ KSCN溶液 AgSCN 酸性溶液(pH≈2)中NO3- Fe2++O2+4H+=4Fe3++2H2O Ag+ 0.05mol/LNaNO3溶液 FeCl2溶液或FeSO4溶液 Fe2++Ag+![]() Fe3++Ag
Fe3++Ag
【解析】(1)银与足量硝酸反应生成硝酸银溶液,再滴加盐酸,有白色沉淀氯化银产生;正确答案:加硝酸,微热,溶解固体,再滴加稀盐酸;
(2)滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,溶液中含有Fe2+;Fe与Ag+间发生置换反应生成银;正确答案:Fe+2Ag+=Fe2++2Ag;
(3)铁与铁离子可以发生归中反应,生成Fe2+;正确答案:Fe+2Fe3+=3Fe2+;铁离子与硫氰化钾溶液相遇,溶液变红;白色沉淀为可能为银离子与硫氰根离子生成了硫氰化银白色沉淀;①正确答案:AgSCN;②因“未生成其他含氮物质”,也就是说硝酸(或酸性条件下的NO3-)没有氧化Fe2+;有可能Fe2+是被氧气在酸性条件下氧化为Fe3+,正确答案:酸性溶液(pH≈2)中NO3-;Fe2++O2+4H+=4Fe3++2H2O; 溶液中还含有银离子,具有一定的氧化性,有可能银离子氧化亚铁离子;正确答案:银离子;
③满足相同条件下,向硝酸酸化的(pH=2) 0.05mol/L硝酸钠溶液中加入过量铁粉,铁先被硝酸氧化为铁离子,取上层清液清加KSCN溶液,3min时溶液呈浅红色,然后生成的铁离子又被过量的铁还原为亚铁离子,30min后溶液几乎无色。正确答案:0.05mol/L硝酸钠溶液;
④根据题给信息,左池蓝色沉淀较少,说明亚铁离子浓度减少了;再向左池再滴加的FeCl2浓溶液,指针偏转,说明反应向生成铁离子方向进行,证明了银离子氧化亚铁离子:Fe2++Ag+![]() Fe3++Ag;正确答案:FeCl2浓溶液或FeSO4浓溶液;Fe2++Ag+
Fe3++Ag;正确答案:FeCl2浓溶液或FeSO4浓溶液;Fe2++Ag+![]() Fe3++Ag;
Fe3++Ag;


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】实验室按照图1所示装置制备氯酸钾、氯水并进行有关探究实验。
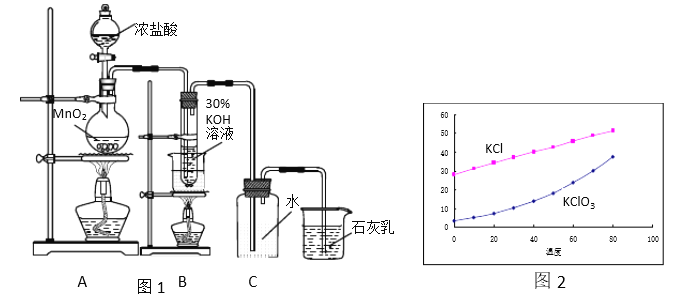
Ⅰ实验一 制取氯酸钾和氯水
(1)A中发生反应的化学方程式是_____________。
(2)制备KClO3需在70℃~80℃进行,写出制备KClO3的离子方程式______。
(3)装置C的作用是_____ 。
(4)KCl 和KClO3的溶解度如图2所示。反应结束后,将装置B中的溶液放到冰水浴中, 20秒后会析出较多晶体X。这样做是因为________(选填a、b、c):
a. KClO3溶解度受温度影响较大而KCl溶解度受温度影响较小
b. 0℃时,KClO3溶解度比KCl小
c. 溶液中的溶质主要是KClO3
所以在冷却过程中晶体X会沉淀析出,X的化学式是_______。
(5)上一步操作会不可避免地使另一种物质同时析出,因此要获得较纯净的X,需要进行的具体的操作步骤是_________________。
Ⅱ实验二 氯酸钾性质研究
(6)在不同条件下KClO3可将KI氧化为不同的产物。该小组设计了如下实验,研究反应条件对反应产物的影响(实验在室温下进行):
0.20 mol·L KI/ mL | KClO3(s) /g | 6.0 mol·L-1 H2SO4/ mL | 蒸馏水/ mL | |
试管1 | 1.0 | 0.10 | 0 | 9.0 |
试管2 | 1.0 | 0.10 | 3.0 | 6.0 |
①该实验的实验目的是__。
②设计试管1实验的作用是_____。
③实验后发现,试管2中产生黄色溶液,该同学预测KI被氧化为I2。用离子方程式表示该同学的预测____________;请设计2种实验方案验证该预测正确(从加入试剂、现象、结论等方面描述)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2) 被誉为“固体润滑剂之王”,利用低品质的辉钼矿( 含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:
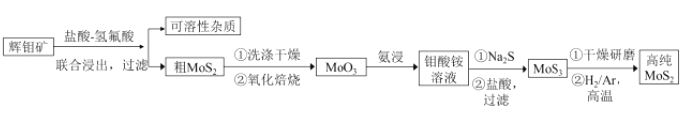
回答下列问题:
(1)钼酸铵的化学式为(NH4)2MoO4,其中Mo的化合价为________.
(2)利用联合浸出除杂时,氢氟酸可除去的杂质化学式为________如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式________。
(3)加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式____________。
(4)由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是___________。
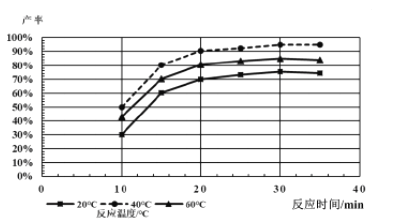
利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因:__________。
(5)高纯MoS2中3然会存在极微量杂质,如非整比晶体MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为________________。
(6)已知Ksp(BaSO4) =1.1×10-10,Ksp(BaMoO4)=4.0×10-8),钼酸钠品体( NaMoO4·2H2O) 是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的c(MoO42-)/c(SO42-)___________(结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。下列关于有机物分子的成键方式的描述不正确的是( )
A. 烷烃分子中碳原子均采用sp3杂化轨道成键
B. 炔烃分子中碳碳叁键由1个σ键、2个π键组成
C. 甲苯分子中所有碳原子均采用sp2杂化轨道成键
D. 苯环中存在6个碳原子共有的大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可构成原电池。试回答下列问题: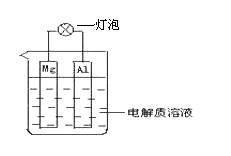
(1)电解质溶液为浓硝酸时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为: ;
b.若灯泡不亮,其理由为:
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极反应式为: ;Al电极反应式为: 。
b.若灯泡不亮,其理由为: 。
(3)(Ⅰ)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):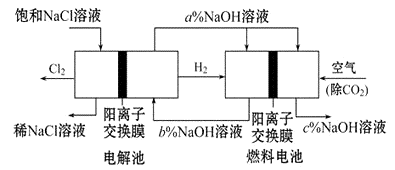
回答下列有关问题:
原电池的负极反应式为。
(4)a、b、c的大小关系为:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合全部正确的是
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | 氯化钠 | 水 | 氯气 |
B | 硫酸 | 碳酸钙 | 四氯化碳 |
C | 氯化银 | HD | 蔗糖 |
D | 氢氧化钡 | 次氯酸 | 乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4 , 下列说法正确的是( )
A.O4和O2互为同位素
B.O4转化O2为物理变化
C.18O是氧元素的一种核素,它的中子数是8
D.同温同压下,等体积的O4气体和O2含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )
选 项 | A | B | C | D |
物 质 | Na2O2 | H2O | HCl | NaCl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用某浓度的NaOH溶液滴定20.00mL等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是
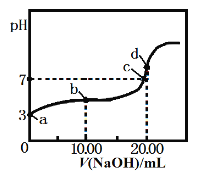
A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com