
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
分析 A.硫酸氢钠在熔融状态下电离出钠离子和硫酸根离子;
B.含有自由移动离子或电子的物质能导电;
C.硫酸在水分子的作用下电离出自由移动的阴阳离子;
D.HCl、NaCl都是强电解质,不含自由移动离子的强电解质不导电.
解答 解:A.硫酸氢钠在熔融状态下电离出钠离子和硫酸根离子,在水溶液中电离出Na+、H+和SO42-,故A错误;
B.含有自由移动离子或电子的物质能导电,氯化钠的水溶液中,NaCl在水分子的作用下电离出自由移动的Na+和Cl-,所以氯化钠溶液能导电,故B正确;
C.硫酸在水分子的作用下电离出自由移动的阴阳离子,不需要电流,故C错误;
D.不含自由移动离子的强电解质不导电,HCl、NaCl都是强电解质,但因为液态HCl、固态NaCl不含自由移动的离子,所以不导电,故D错误;
故选B.
点评 本题考查电解质的电离及物质导电性,为高频考点,知道物质导电原理即可解答,易错选项是AC,注意硫酸氢钠在水溶液中和熔融状态下电离方式的区别,注意电解质不一定导电,导电的不一定是电解质,为易错点.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题

 ,B的结构式为
,B的结构式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

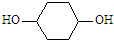 ,写出正确的合成路线:
,写出正确的合成路线: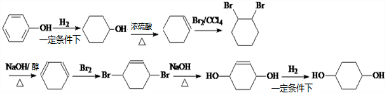 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.
(1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦⑧ | B. | ①④⑤⑥⑦ | C. | ④⑤⑥⑦⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- | |
| B. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| C. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| D. | 0.1mol•L-1NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com