
下列有关化学用语表示正确的是( )
A.甲基的电子式: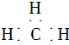
B.镁离子的结构示意图:
C.质量数为34、中子数为18的核素: S
S
D.乙酸的结构简式:
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol/LKOH溶液,下列说法中正确的是
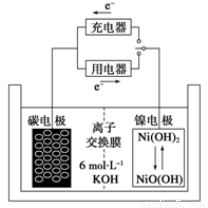
A.放电时K+移向负极
B.放电时电池负极的电极反应为H2-2e-=2H+
C.放电时电池正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该电池充电时将碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示。
下列说法不正确的是
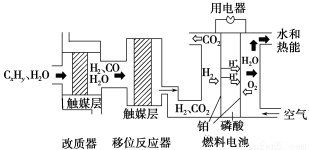
A.该系统中只存在化学能和电能的相互转化
B.在移位反应器中,反应CO(g)+H2O(g) 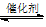 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大
CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大
C.改质器和移位反应器的作用是将CxHy转化为H2和CO2
D.该电池正极的电极反应为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
下列溶液中各离子的浓度关系不正确的是( )
A. 0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
B. 浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:
c(CO )+c(OH-)=c(H+)+c(H2CO3)
)+c(OH-)=c(H+)+c(H2CO3)
C. 25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:
c(Na+>c(CN-)>c(HCN)>c(OH-)
D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:
c(Na+)>c(CO )>c(HCO
)>c(HCO )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 25 ℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA
B. 1.2 g C60和石墨的混合物中,含有的碳原子数目为0.1NA
C. 2.24 L N2和NH3的混合气体中,含有的共用电子对数目为0.3NA
D. 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
N2+3H2一定条件2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
A.增加N2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率
D.若反应在密闭容器中进行,N2和H2能100%转化为NH3
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
下列化学用语正确的是()
A.氯化钠的电子式: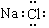 B.乙烯的结构简式:C2H4
B.乙烯的结构简式:C2H4
C.硅的原子结构示意图: . D.硫酸的电离方程式:H2SO4==H22++SO42
. D.硫酸的电离方程式:H2SO4==H22++SO42
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是

A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
B.2SO2(g) + O2(g) 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
C.2NO+2CO 2CO2+N2 的ΔH<0,常温下该反应一定能自发进行
2CO2+N2 的ΔH<0,常温下该反应一定能自发进行
D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:选择题
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1 ℃ | T2 ℃ | T1 ℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
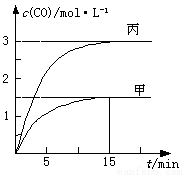
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com