
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
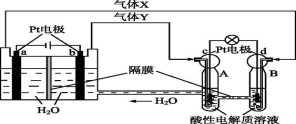
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B中的H+可以通过隔膜进入A
D.d极上发生的电极反应是:O2+4H++4e- =2H2O
科目:高中化学 来源:2017届山东省潍坊市临朐县高三12月阶段测化学试卷(解析版) 题型:填空题
硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。
⑴利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+1/2O2(g) SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
①该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _________ v (逆)(填“<”、“>”或“=”)。
(逆)(填“<”、“>”或“=”)。
②该温度下,向一体积为2 L的恒容密闭容器中充入2.0 mol SO2和1.0 molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为_______________。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__________(填字母)。
A.保持 温度和容器体积不变,充入1.0 mol O2
温度和容器体积不变,充入1.0 mol O2
B.升高温度
C.保持温度和容器体积不变,充入1.0  mol SO3
mol SO3
D.增大容器体积
⑵室温下,Li /FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是___________________。
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产生物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等,请写出化学反应方程式:第一次放电:__________________;第二次放电:________________。
⑶制取高纯度黄铁矿的另一种方法是:以LiCl—KCl低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解,写出阳极方程式______________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期末化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s)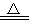 Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。

③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、低温干燥,得到产品。
回答问题:
(1) Na2S2O3 中硫元素的化合价为_____________;Na2S2O3在强酸性溶液中不能稳定存在,其原因为___________________(用离子方程式表示)。
(2)仪器a的名称是________,其作用是________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验其是否存在的方法是___________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定(反应原理为:2S2O +I2===S4O
+I2===S4O +2I-)。
+2I-)。
(4)滴定至终点时,溶液颜色的变化:_____________。
(5)滴定结束后消耗碘的标准溶液体积为20.00mL。产品的纯度为(用含W的代数式表示)_____________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期末化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. Na与乙醇反应时的反应速率比与水反应时的慢
B. 除去乙烷中混有的少量乙烯的方法可以是将其通入溴水中C﹒已知 和
和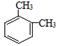 是同一种物质,说明苯分子中的碳碳键不是单双键交替的
是同一种物质,说明苯分子中的碳碳键不是单双键交替的
C. 苯不能使酸性高猛酸钾溶液褪色,所以苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知: N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应生成氮气和气态水的热化学方程式:________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施): ____________________。
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) △H=bkJ•mol﹣1,其化学平衡常数K值和温度的关系如下:
2NH3(g) △H=bkJ•mol﹣1,其化学平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
写出该反应的化学平衡常数的表达式: ,b 0(填“大于”、“小于”或“等于”)
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) v逆(N2)(填“大于”、“小于”或“等于”)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为______________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为___________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=__________(不考虑溶液体积变化) 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高一上模拟考试化学卷(解析版) 题型:计算题
将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:
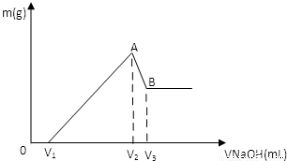
(1)写出A→B段反应的离子方程式  。
。
(2)A点沉淀的总物质的量n= 。
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积为多少mL?(写出计算过程,下同)
(4)若V1=60mL,则混合物中Mg的物质的量为多少? V3点所加NaOH溶液的体积为多少mL?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高一上模拟考试化学卷(解析版) 题型:选择题
如图所示在密封容器中,一部分装入2.3 g金属钠,另一部分装入HgO,同时加热两部分,若加热后容器内的空气成分未变,那么装入容器中的HgO是

A.21.7 g B.20.0g C.1.6 g D.10.8 g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高一上模拟考试化学卷(解析版) 题型:选择题
下列有关纯净物、混合物、电解质、非电解质的正确组合为
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 盐酸[来 | 淀粉溶液 | 硫酸 | 液氨 |
B | 漂粉 | 水玻璃 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 氢氧化铁胶体 | 碳酸钠[来 | 乙醇 |
D | 水银 | 澄清石灰水 | 氯化铜 | 铁 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三第二次诊断性考试化学试卷(解析版) 题型:推断题
[化学—选修5:有机化学基础]缩醛在有机合成中常用于保护羰基或作为合成中间体,同时还是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。下面是G的一种合成路线:
已知:
① 芳香烃A含氢元素的质量分数为8.7%,A的质谱图中,分子离子峰对应的最大质荷比为92;D的产量可以用来衡量一个国家的石油化工发展水平。
② 
③ 同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的结构简式是 ,E的名称是 。
(2)由D生成E的反应类型是 ,E→F的反应条件是 。
(3)由B生成N的化学方程式为 。
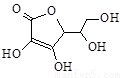
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉、效率高、污染物少的优点。维生素C的结构如右图。则维生素C分子中含氧官能团名称为 。
(5)缩醛G的结构简式为 。G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式: 。
①既能发生银镜反应,又能与FeCl3发生显色反应;②核磁共振氢谱为4组峰。
(6)写出用2-丁烯为原料(其他无机试剂任选)制备顺丁橡胶(顺式聚1, 3-丁二烯)的合成路线: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com