
| A��C2H5OH(l)��3O2(g)=2CO2(g)��3H2O(g) ; ��H��-1 367.0 kJ��mol��1(ȼ����) |
| B��Ba(OH)2(aq)��2HCl(aq)=BaCl2(aq)��2H2O(l); ��H��-57.3 kJ��mol��1(���) |
| C��S(s)��O2(g)=SO2(g); ��H����269.8 kJ��mol��1(��Ӧ��) |
| D��2NO2=O2��2NO; ��H����116.2 kJ��mol��1(��Ӧ��) |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI(g)����H1����9.48 kJ/mol
2HI(g)����H1����9.48 kJ/mol 2HI(g)����H2����26.48 kJ/mol
2HI(g)����H2����26.48 kJ/mol| A��254 g I2(g)��ͨ��2 g H2(g)����Ӧ����9.48 kJ |
| B��I2(g)=I2(s)����H����17.00 kJ/mol |
| C����̬����ȶ��Ա���̬����ȶ��Ը� |
| D��1 mol��̬���1 mol��̬��ֱ���������ȫ��Ӧ��ǰ�߶��ѵ�I��I������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ȷ�Ӧ����Ҫ���ȾͿ��Է��� |
| B����ѧ��Ӧ���������������⣬�������������ı仯 |
| C����Ӧ����Ϊ���ȵķ�Ӧ�������ȷ�Ӧ |
| D����ѧ��Ӧ���Ȼ������ȣ�ȡ���ڷ�Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3��g����H =" -197" kJ/mol��ʵ������ʼ��ƽ��ʱ���й���
2SO3��g����H =" -197" kJ/mol��ʵ������ʼ��ƽ��ʱ���й���| ���� | ��ʼ�����ʵ����ʵ���/mol | �ﵽƽ��ʱ��ϵ�����ı仯 | ||
| SO2 | O2 | Ar | ||
| �� | 2 | 1 | 0 | �ų�������Q1 |
| �� | 2 | 1 | 0 | �ų�������Q2 |
| �� | 2 | 1 | 0.5 | �ų�������Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ȼ����Ϊ890.3 kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O(g)��H=-890��3 kJ��mol-1 |
B����N2��g��+3H2��g�� 2NH3��g����H=-92��4 kJ��mol-1�Ȼ�ѧ����ʽ��֪�� ����Ӧ��ת��6NA����ʱ����Ӧ�ų�����С��92.4 kJ 2NH3��g����H=-92��4 kJ��mol-1�Ȼ�ѧ����ʽ��֪�� ����Ӧ��ת��6NA����ʱ����Ӧ�ų�����С��92.4 kJ |
| C��HCl��NaOH��Ӧ���к��ȡ�H="-57.3" kJ��mol-1����H2SO4��Ca��OH��2��Ӧ���к��ȡ�H=2����-57��3��kJ��mol-1 |
| D����101 kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285��8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)=2H2O(1)��H=-571��6 kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H1����H2����H3 | B����H2����H3����H1 |
| C����H2����H1����H3 | D����H1����H3����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��X������һ������M |
| B��Y������һ������N |
| C��X��Y��������һ������M��N�������� |
| D����÷�ӦΪ���ȷ�Ӧ���ʲ��ؼ��ȾͿɷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H1����H2����H3 | B����H1����H2����H3 |
| C����H1����H2����H3 | D����H1����H2����H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
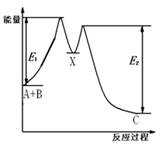
| A��E2��ʾ��ӦX��C�Ļ�� |
| B����ӦA��B��C�ġ�H<0 |
| C��X�Ƿ�ӦA��B��C�Ĵ��� |
| D����������ɸı䷴ӦA��B��C���ʱ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com