
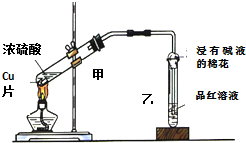
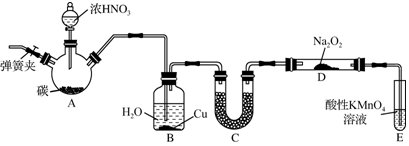
 用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.
用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.分析 (1)铜与浓硫酸反应生成硫酸铜,硫酸铜难溶于浓硫酸;
(2)反应生成硫酸铜和二氧化硫,硫元素的化合价降低;
(3)A.二氧化硫不能漂白石蕊试液;
B.应先停止加热,后将乙处导管从溶液中取出会发生倒吸;
C.不能直接向试管中加入适量水,浓硫酸剩余时加水放出大量的热可导致液滴飞溅;
D.二氧化硫是有毒气体,二氧化硫能被氢氧化钠溶液吸收.
解答 解:(1)在加热条件下铜与浓硫酸发生:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,反应生成的硫酸铜难溶于浓硫酸,所以白色固体是CuSO4;
故答案为:CuSO4;
(2)反应生成硫酸铜,表现了硫酸的酸性,生成二氧化硫,硫元素的化合价降低,体现了浓硫酸的氧化性;
故答案为:酸性;
(3)A.二氧化硫不能漂白石蕊试液,二氧化硫溶于水显酸性,能使石蕊试液变红色,但是不能褪色,故A错误;
B.应先停止加热,后将乙处导管从溶液中取出会发生倒吸,所以应该先将乙处导管从溶液中取出,再停止加热,故B错误;
C.不能直接向试管中加入适量水,浓硫酸剩余时加水放出大量的热可导致液滴飞溅,则取反应后的白色固体在烧杯中加水溶解观察是否变为蓝色,故C错误;
D.二氧化硫是有毒气体,二氧化硫能被氢氧化钠溶液吸收,所以浸有碱液的棉花的作用是吸收尾气,防止污染环境,故D正确.
故答案为:D.
点评 本题考查硫酸与铜反应的知识,题目难度不大,注意该反应的化学方程式以及二氧化硫的性质,为解答该题的重要问题,侧重于考查学生的分析能力和对基础知识的应用能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
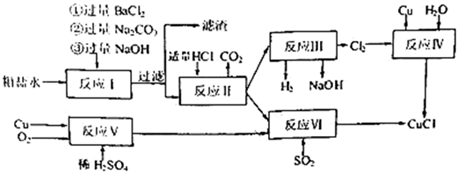
如下流程示意图是用无机矿物资 源生产部分材料。
源生产部分材料。 下列有关说法不正确的是
下列有关说法不正确的是
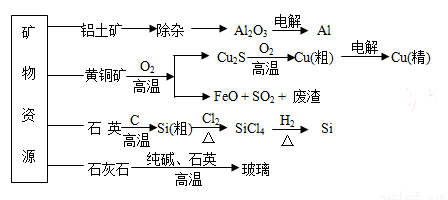
A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸 ,FeO可用作冶炼铁的原料
,FeO可用作冶炼铁的原料
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2 + 2H2O===Ca(OH)2 + 2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
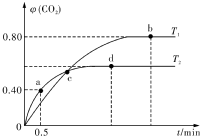 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)═5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4molCO,测得CO2的体积分数随时间t变化曲线如图.请回答:
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)═5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4molCO,测得CO2的体积分数随时间t变化曲线如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
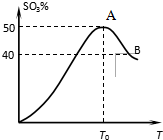 在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数
在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com