
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 石灰石 | 水 |
| D | 苛性钾 | 碳酸 | 苏打 | 三氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
分析 酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是电离产生的阴离子全部为氢氧根离子的化合物;盐是由金属离子和酸根离子组成的化合物;酸性氧化物是指能和碱反应生成盐和水的化合物,据此回答判断.
解答 解:A、纯碱是碳酸钠的俗称,属于盐类,不属于碱类,故A错误;
B、一氧化碳和碱之间不反应,不属于酸性氧化物,故B错误;
C、水属于氧化物,但是不会和碱反应生成盐和水,不属于酸性氧化物,故C错误;
D、苛性钾是氢氧化钾的俗称,属于碱,苏打是碳酸钠的俗称属于盐;三氧化硫可以和碱反应生成盐和水,属于酸性氧化物,故D正确.
故选D.
点评 本题考查学生物质的分类知识,注意基本概念的理解和掌握是关键,难度中等.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
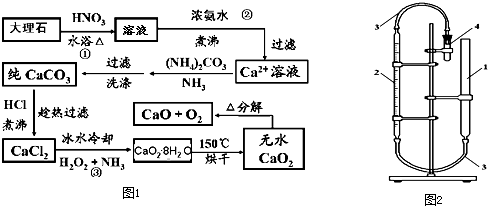
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1 kJ/mol | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2 kJ/mol | K2 | 2.38 | 1.72 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g)△H=QkJ/mol | K | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | V正减小,V逆增大 | B. | V正增大,V逆减小 | C. | V正V逆都增大 | D. | V正V逆都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol•L-1Na2SO4溶液中Na+个数为2NA | |
| B. | 18g水含有电子数为10NA | |
| C. | 标准状况下,22.4LH2约含有2NA个H | |
| D. | 11.2LH2一定含有NA个H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3、NH3的水溶液均能导电,所以均是电解质 | |
| B. | 蔗糖、酒精在水溶液中和熔融态时均不导电,所以它们是非电解质 | |
| C. | 液态硫酸、固态硫酸钡不能导电,所以二者均不是电解质 | |
| D. | 钢铁、石墨均导电,所以它们是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com