
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
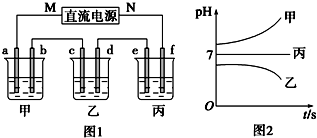
分析 测得乙中c电极质量增加了16g,由表可知乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH;
(1)c电极析出Cu,所以c为阴极,则M为负极;b为阳极,电极上是氢氧根离子失电子生成氧气;
(2)根据生成的Cu的量求出转移的电子的物质的量,再根据电子守恒求出e上生成的气体的量;
(3)乙烧杯中电解的是硫酸铜溶液;
(4)要使丙恢复到原来的状态,根据电解实质和生成产物,需要加入水,依据析出铜的质量,根据电子守恒,求出水的质量.
解答 解:测得乙中c电极质量增加了16g,由表可知乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH;
(1)c电极析出Cu,由铜离子在阴极得电子生成Cu可知c为阴极,则M为负极,N为正极;b与正极相连,则b为阳极,所以b电极上是氢氧根离子失电子生成氧气,其电极反应式为:4OH--4e-=2H2O+O2↑;
故答案为:负;4OH--4e-=2H2O+O2↑;
(2)e与电源负极相连为阴极,则e电极上是氢离子得电子生成氢气,已知n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.25mol×22.4L/mol=5.6L;
故答案为:5.6L;
(3)乙烧杯中为惰性电极电解硫酸铜溶液,总反应为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(4)丙中的电解质是硫酸钠或硫酸钾,电解时被电解的是水,所以要使丙恢复到原来的状态,需加水;已知n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,由Cu~2e-~H2↑~H2O,则n(H2O)=0.25mol,所以需要加入m(H2O)=0.25mol×18g/mol=4.5 g,即向丙烧杯中加4.5 g水,
故答案为:向丙烧杯中加4.5 g水.
点评 本题考查了电解原理,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S不变,K变大,O2转化率增大 | B. | S不变,K变大,SO2转化率减小 | ||
| C. | S变小,K不变,O2转化率减小 | D. | S增大,K不变,SO2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2-、K+、CO32-、Na+ | B. | Na+、OH-、H2PO4-、NO3- | ||
| C. | Al3+、Cl-、CO32-、Na+ | D. | Fe2+、K+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 咖啡酸(如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别是对内脏的止血效果较好.下列关于咖啡酸的说法正确的是( )
咖啡酸(如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别是对内脏的止血效果较好.下列关于咖啡酸的说法正确的是( )| A. | 咖啡酸的分子式为C9H5O4 | |
| B. | 咖啡酸的某种同分异构体,其苯环上可能连有4个羟基 | |
| C. | 1 mol咖啡酸最多可以和2 mol NaOH反应 | |
| D. | 可以用高锰酸钾或溴水检验咖啡酸分子中所含的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醇 | B. | 醚 | C. | 醛 | D. | 羧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
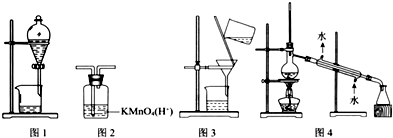
| A. | 图1(分离乙醇和乙酸) | B. | 图2(除去乙炔中的乙烯) | ||
| C. | 图3(除去溴苯中的溴单质) | D. | 图4(除去工业酒精中的甲醇) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,H2O是还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比是1:2 | |
| C. | 按照化学方程式进行,氧化剂失电子1 mol | |
| D. | Cl2既是氧化剂又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com