
| A.反应后的溶液中加入氯水不变色 |
| B.反应后的溶液可继续溶解金属铜 |
C.原混台物中氧化铁的物质的量为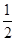 (a-b)mol (a-b)mol |
| D.原混合物中单质铁的物质的量为b mol |
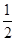 (a-b)mol,C正确;D、共含铁bmol+
(a-b)mol,C正确;D、共含铁bmol+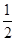 (a-b)mol=
(a-b)mol=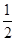 (a+b)mol,D不正确,答案选C。
(a+b)mol,D不正确,答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
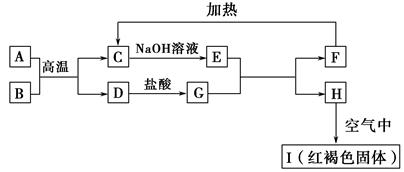
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
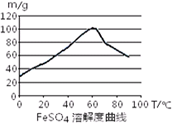
| A.浓硫酸 | B.10moL/L硫酸 | C.3moL/L硫酸 | D.任意浓度硫酸; |
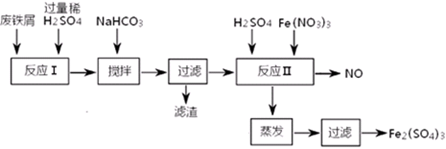
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
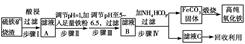
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
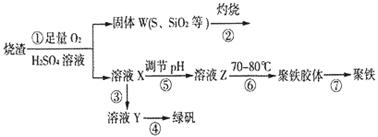
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硅可用作半导体材料 | B.硝酸常用作金属铜加工前的酸洗 |
| C.碳酸钠可用于治疗胃酸过多 | D.三氧化二铁常用于生产红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
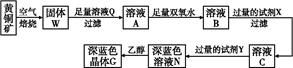
| | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
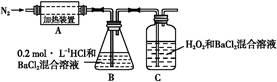
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
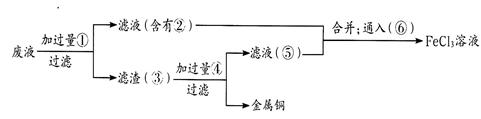
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com