
下列变化是在克服分子间作用力的情况下进行的是( )。
A.碘的升华 B.氨的液化
C.铝的熔化 D.食盐的溶解
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学 题型九 速率平衡型专题练习卷(解析版) 题型:选择题
在1 L密闭容器中发生反应:4NH3(g)+5O2(g)??4NO(g)+6H2O(g) ΔH=-Q kJ·mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
时间/浓度 | c(NH3) (mol·L-1) | c(O2) (mol·L-1) | c(NO) (mol·L-1) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
第10 min | 0.7 | 1.475 | 0.1 |
下列说法错误的是( )
A.反应在第2 min到第4 min时,O2的平均反应速率为0.187 5 mol·L-1·min-1
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min、第8 min时分别达到化学平衡,且平衡常数相同
D.在开始反应的前2 min内,该反应放出0.05Q kJ的热量
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学训练2.2.2分子空间构型分子性质练习卷(解析版) 题型:填空题
元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)确定X、Y两种元素在周期表中的位置。X:____________;Y:____________。
(2)在X和Y两种元素形成的化合物中,写出X的质量分数为50%的化合物的化学式____________;该分子是____________(填“极性”或“非极性”)分子,分子构型为____________。
(3)写出X的质量分数为60%的化合物的化学式________;该分子中,中心原子以________杂化,是____________(填“极性”或“非极性”)分子,分子构型为____________。
(4)由氢、X、Y三种元素形成的常见化合物有两种,其水溶液均呈酸性,试分别写出其分子式____________、____________,并比较酸性强弱____________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学训练1.2.2核外电子排布元素周期表练习卷(解析版) 题型:选择题
下列表示式错误的是( )。
A.Na+的轨道表示式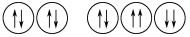
B.Na+的结构示意图: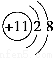
C.Na的电子排布式:1s22s22p63s1
D.Na的简化电子排布式:[Ne]3s1
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学规范训练2.4分子间作用力物质性质练习卷(解析版) 题型:选择题
如果取一块冰放在容器里,不断地升高温度,可以实现“冰→水→水蒸气→氢气和氧气”的变化,在各步变化时破坏的粒子间的相互作用力依次是( )。
A.氢键、极性键、非极性键
B.氢键、氢键、极性键
C.氢键、氢键、非极性键
D.氢键、非极性键、极性键
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:填空题
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
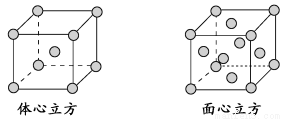
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:选择题
最近科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )。
A.该物质的化学式为CO4
B.晶体的熔、沸点高,硬度大
C.晶体中C原子数与C—O键数之比为1∶4
D.晶体的空间最小环共由12个原子所构成
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2章化学键分子间作用力练习卷(解析版) 题型:填空题
A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。
请填空:
(1)在B的单质分子中存在________个π键,________个σ键。
(2)已知B的气态氢化物很容易与H+结合,B原子与H+间形成的键叫________,形成的离子立体构型为________,其中B原子采取的杂化方式是________。
(3)在A、B、C、D四种元素形成的电子数相同的四种氢化物中,沸点最低的是________(写分子式),其沸点显著低于其他三种氢化物的原因是:________________________。
(4)A的氢化物易溶于水,而D的氢化物难溶于水,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:填空题
Ⅰ.已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au。其堆积方式为:
(1)简单立方堆积的是____________________________________________;
(2)钾型的是______________________________________________________;
(3)镁型的是______________________________________________________;
(4)铜型的是_____________________________________________________。
Ⅱ.A、B、C、D都是短周期元素,原子半径D>C>A>B,已知:A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。
试回答:
(1)这四种元素分别是:A______,B______,C______,D______(填元素名称)。
(2)这四种元素单质的熔点由高到低的顺序是________(填元素名称)。
(3)C的固态氧化物是________晶体,D的固态单质是________晶体。
(4)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com