
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO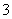 )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是 ( )
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是 ( )
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
答案 A
解析 石墨作电极电解KNO3和Cu(NO3)2的混合溶液,阳极反应式为4OH--4e-===2H2O+O2↑,阴极先后发生两个反应:Cu2++2e-===Cu,2H++2e-===H2↑。从收集到O2为2.24 L这个事实可推知上述电解过程中共转移0.4 mol 电子,而在生成2.24 L H2的过程中转移0.2 mol电子,所以Cu2+共得到0.4 mol-0.2 mol=0.2 mol电子,电解前Cu2+的物质的量和电解得到的Cu的物质的量都为 0.1 mol。电解前后分别有以下守恒关系:c(K+)+2c(Cu2+)=c(NO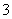 ),c(K+)+c(H+)=c(NO
),c(K+)+c(H+)=c(NO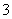 ),不难算出:电解前c(K+)=
),不难算出:电解前c(K+)=
0.2 mol·L-1,电解后c(H+)=0.4 mol·L-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、B、C、D、E都是短周期元素,原子序数依次增大,元素B的原子价电子构型为ns2npn+2 。B、C同周期, C为周期表中电负性最大的元素,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴写出A、B、C、D、E元素符号___、___、___、___、___、
⑵B原子的电子排布图为_________________。D离子的电子排布式为______________________,甲、乙两分子中含有非极性共价键的物质的电子式是___________________,
⑶DBA中的化学键类型为____________、____________属于 化合物(填“离子”或“共价”)
⑷A的硫化物中,A原子以 杂化轨道成键,分子空间构型为 ;
(5)分别写出DBA水溶液与E、DBA与E的氧化物反应的化学方程式.
_____ ______ _______
_______ ______ _______ __
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应限度的叙述不正确的是
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.达到平衡状态时,反应物的转化率已经最大
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总化学方程式_____________________________________________________________。
(4)用铜作电极电解盐酸溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(5)用Al作电极电解NaOH溶液
阴极反应式_______________________________________________________________;
阳极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(6)用惰性电极电解熔融MgCl2
阴极反应式_______________________________________________________________;
阳极反应式_______________________________________________________________;
总反应离子方程式________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是 ( )
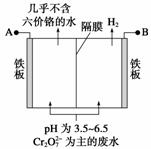
A.A为电源正极
B.阳极区溶液中发生的氧化还原反应为
Cr2O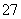 +6Fe2++14H+===2Cr3++6Fe3+
+6Fe2++14H+===2Cr3++6Fe3+ +7H2O
+7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O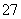 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
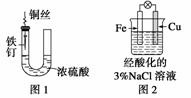
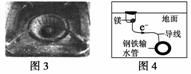
下列与金属腐蚀有关的说法,正确的是 ( )
A.图1中 ,铁钉易被腐蚀
,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)= ==2PbSO4(s)+2H2O(l)
==2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是 ( )
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2+4H++2e-===Pb2++2H2O | 阳极:2Al+3H2O-6e-===Al2O3+6H+ |
| D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为___________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸 门上的固体材料R可以采用________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com