
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:______________________,其中含有的化学键是________________。
(2)用电子式表示Y2O的形成过程:_______________________________________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是__________(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是_________(填化学式)。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物的化学式:__________。
【答案】 ![]() 离子键、共价键
离子键、共价键 ![]() HClO4 NH3 NCl3
HClO4 NH3 NCl3
【解析】本题综合考查元素周期律与化学键,元素化合物性质知识。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2离子化合物,则Y为钠元素,X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,X原子序数都小于钠,所以X为氮元素,Z、W原子序数都大于钠,Z为硫元素,W为氯元素。
解析:(1)Y2O2为Na2O2,Na2O2为离子化合物,其电子式为![]() ,过氧化钠中含有的化学键为离子键、共价键;(2)Na2O为离子化合物,用电子式表示Na2O的形成过程为:
,过氧化钠中含有的化学键为离子键、共价键;(2)Na2O为离子化合物,用电子式表示Na2O的形成过程为:
![]() ;(3)非金属性越强,元素的最高价氧化物对应的水化物的酸性越强,在氮、硫、氯中氯元素的非金属性最强,所以酸性最强的是HClO4;(4)NH3与H2S和HCl都能反应,生成对应的铵盐;(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,则该化合物为NCl3,遇水可生成一种具有漂白性的化合物为次氯酸和一种刺激性气味的气体则为氨气,反应的化学方程式为NCl3+3H2O═3HClO+NH3。
;(3)非金属性越强,元素的最高价氧化物对应的水化物的酸性越强,在氮、硫、氯中氯元素的非金属性最强,所以酸性最强的是HClO4;(4)NH3与H2S和HCl都能反应,生成对应的铵盐;(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,则该化合物为NCl3,遇水可生成一种具有漂白性的化合物为次氯酸和一种刺激性气味的气体则为氨气,反应的化学方程式为NCl3+3H2O═3HClO+NH3。


科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。
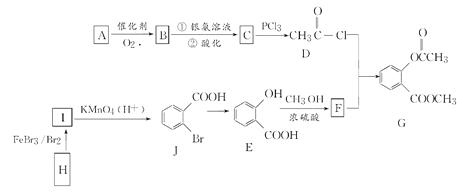
已知:![]()
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为________,B与银氨溶液反应的化学方程式是_______________________________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是________________________________________________________________________。
(5)满足以下条件的F的同分异构体(含F)共有________(填数字)种。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有-COO-结构 ③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
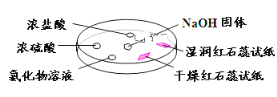
选项 | 实验现象 | 解释 |
A | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是MgCl2溶液 |
D | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为(58.5×c/ρ×1000)×100%
C. 将1 L该NaCl溶液蒸干可好到58.5c gNaCl固体
D. 20℃时,NaCl的溶解度S=(5850c/(ρ58.5))g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A.铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑
B.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
C.铁与氯化铜溶液反应:Fe+Cu2+=Fe2++Cu
D.碳酸钙跟稀盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:

(1)PMMA单体的官能团名称是________
(2)②的化学方程式为_______________________________________
(3)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为___________________________
(4)G的结构简式为________________________________
(5)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是______________
(6)写出由PET单体制备PET聚酯并生成B的化学方程式:________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的数字序号分别代表一种化学元素
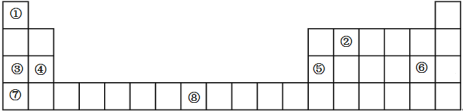
试回答下列问题:
(1)请画出⑧号元素的基态原子价电子排布图_________________________。
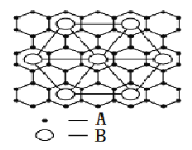
(2)②号元素(用A表示)形成的一种同素异形体与熔融的⑦号元素(用B表示)形成单质形成A元素间隙化合物,比较常见的A元素间隙化合物是青铜色的化合物,其化学式可写作Ax B,其平面图形见图,则x值为____________。
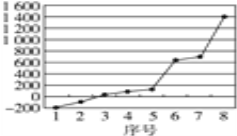
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_______(填元素符号);其中电负性最大的是______(填图中的序号)(稀有气体除外)。
(4)⑤号元素形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
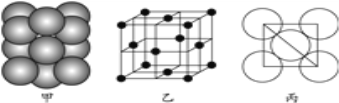
若已知⑤号元素原子半径为d cm,NA代表阿伏加德罗常数,该元素的相对原子质量为M,则该晶体的密度为____________ g·cm-3(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com