
【题目】向铁铜合金中加入过量的硝酸溶液,得到NO2、N2O4、NO混合气体,向反应后溶液中加入2mol/LNaOH溶液,至沉淀恰好完全.若将得到的NO2、N2O4、NO混合气体,与2.24L(标准状况下)O2混合后通入水中恰好被完全吸收生成硝酸.则反应中消耗的NaOH溶液的体积是( )
A.150ml
B.180ml
C.200ml
D.250ml
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是( ) 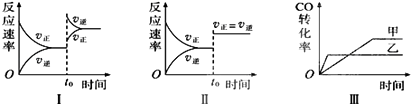
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.离子化合物中一定含有金属元素B.原子晶体熔化要破坏共价键
C.构成分子晶体的微粒中一定含有共价键D.只有离子化合物中才存在离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、装置、操作或结论的描述中,正确的(或实验能达到预期目的)有(有关装置中的夹持仪器略去未画)( )项 
Ⅰ仿启普发生器制少量氧气Ⅱ.该装置检查气密性(止水夹已关)一打开分液漏斗活塞,液体顺利流下
Ⅲ进行铜与浓硝酸反应的实验Ⅳ.证明氧化性Cl2>Br2>I2Ⅴ.验证酸性的强弱,H2SO4>H2CO3>HClO.
A.1项
B.2项
C.3项
D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验(已知硝酸根离子在酸性环境中具有强氧化性,还原产物一般为气体)
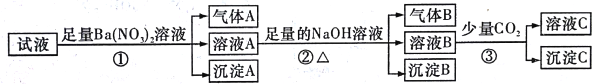
下列有关判断正确的是
A. 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中会迅速变为灰绿色,最后变为红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.用金属钠可区分乙醇和乙醚
B.用高锰酸钾酸性溶液可区分己烷和3﹣己烯
C.用水可区分苯和溴苯
D.用溴的四氯化碳溶液可区分乙烯和乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2 . 图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变 化是(填“增大”、“减小”、“不变”).请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键。下列能量转换过程,不涉及化学变化的是
A. 利用氢氧燃料电池提供电能 B. 利用太阳能分解水制备氢气
C. 利用水流驱动涡轮机发电 D. 利用植物秸秆为原料生产乙醇燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com