
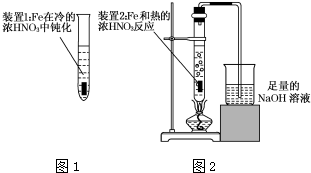
 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:分析 (1)根据铜及氧气、氯气的性质分析;
(2)根据实验时,取用液体的体积及加热液体的注意事项分析;根据实验是否容易控制及反应产物量的多少分析;
(3)①根据二氧化氮的性质分析,二氧化氮能和水反应生成硝酸,当溶液中硝酸过量时,二氧化氮会剩余,气体呈红棕色;
②硝酸过量时,铁和硝酸反应生成三价铁,根据三价铁的性质分析;
(4)先根据Fe3+的特征反应,加入硫氰酸钾溶液判断溶液不含Fe3+,然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在.
解答 解:(1)铜在氧气中不燃烧,在氯气中能燃烧产生棕黄色烟,
故答案为:Cu能在Cl2中燃烧,产生棕黄色的烟;
(2)加热液体时,试管内的液体超过试管的三分之一,超过三分之一时,加热过程中容易产生暴沸,造成安全事故;加热液体的试管不与桌面成45°角向上倾斜,不能竖直向上;改进后的铜丝容易抽拉,即容易控制反应的进行,从而减少氮氧化物的排放,将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞,既能控制反应的进行又能减少氮氧化物的排放;
故答案为:两只试管中的液体均超过试管容积的$\frac{1}{3}$;加热液体的试管不与桌面成45°角向上倾斜;将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞;
(3)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以可看到气体呈红棕色,
故答案为:试管上部出现红棕色气体;
②硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为2Fe3++Cu=Cu2++2Fe2+,
故答案为:Fe和硝酸反应后的溶液中可能有HNO3,但也一定有Fe3+,Fe3+也能和Cu反应而使Cu片溶解;
(4)取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+,
故答案为:取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+.
故答案为:2Fe3++Cu=Cu2++2Fe2+.
点评 本题考查了常见金属铜和铁的化学性质,实验基本操作,难度不大,写三价铁离子和铜反应的离子方程式时要注意电荷守恒,离子检验时注意氧化剂、KSCN溶液的顺序不能颠倒.


科目:高中化学 来源: 题型:填空题
 ②白磷 ③2,3-二甲基丁烷 ④
②白磷 ③2,3-二甲基丁烷 ④

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的物质的量为0.1mol | B. | CO32-的物质的量为0.2mol | ||
| C. | Na+的物质的量浓度为0.1mol/L | D. | CO32-的物质的量浓度为0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| C. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正价:X>Y>Z | B. | 酸性:H3ZO4>H2YO4>HXO4 | ||
| C. | 稳定性:HX>H2Y>ZH3 | D. | 非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com