
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
【答案】B
【解析】A.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,说明Cu2+是H2O2分解反应的催化剂,故A正确;B.根据“蓝色溶液变为红色浑浊(Cu2O)”,说明铜离子被还原成+1价,H2O2表现了还原性;继续加入H2O2溶液,红色浑浊又变为蓝色溶液,说明发生了反应Cu2O+H2O2+4H+═2Cu2++3H2O,Cu2O中+1价Cu被氧化成+2价Cu2+,H2O2又表现了氧化性,故B错误;C.H2O2属于共价化合物,电子式为: ![]() ,故C正确;D.红色浑浊又变为蓝色溶液,Cu2O中+1价Cu被氧化成+2价Cu2+,发生反应为:Cu2O+H2O2+4H+═2Cu2++3H2O,故D正确;故选B。
,故C正确;D.红色浑浊又变为蓝色溶液,Cu2O中+1价Cu被氧化成+2价Cu2+,发生反应为:Cu2O+H2O2+4H+═2Cu2++3H2O,故D正确;故选B。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】除去工业尾气中的氮氧化合物(如NO),常用氨催化吸收法,原理是NH3与NO按一定比例反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上对NO的处理。

(1)装置A的反应中,还原产物是_____。
(2)若选择装置C制取氨气,则反应的化学方程式是______。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
(3)在括号中填入选用的装置编号:![]() 。______、___________
。______、___________
(4)装置D的一种作用是______。
(5)装置B的作用是______(填序号)。
A.吸收氮氧化物 B.吸收氨气 C.干燥反应的混合气体
(6)装置E中发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是( )
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 向1mLlmol·L-1MgCl2溶液中滴加2滴2mol·L-1NaOH溶液,生成白色沉淀;再滴加2滴1mol·L-1'FeCl3溶液,白色沉淀变成红褐色沉淀 | 3Mg(OH)2(s)+2Fe3+(aq) |
B | 比较HClO和CH3COOH的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
D | 检验某溶液中是否含有SO42- | 向该溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钛、镍等过渡元素在工业生产和科学研究中具有重要作用,请回答下列问题。
(1)有机铁肥[Fe(H2NCONH2)6](NO3)3的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子Fe3+的价电子排布式为____________;该配合物中N原子的杂化方式有_______________;它所含非金属元素的电负性由小到大的顺序是__________________。
(2)钛被称为继铁、铝之后的“第三金属”,也叫“未来金属”。
①钛位于周期表的_______区,基态Ti原子的电子占据了____________个原子轨道。
②工业上可用TiCl4(常温下呈液态)与Mg高温下反应制备钛单质,同时生成MgCl2,详细解释TiCl4熔点比MgCl2低很多的原因 _______________________________________________________ 。
(3)镍与CO生成的配合物Ni(CO)4中,易提供孤电子对的成键原子是_______________(填元素名称);1molNi(CO)4中含有的σ键数目为_________________ ;写出与CO互为等电子体的一种离子的化学式___________。
(4)镍钛记忆合金用于飞机和字宙飞船。已知一种钛镍合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为________;若合金的密度为ρg/cm3,NA代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是____________pm。(用含ρ和NA的计算式表示,不必化简)
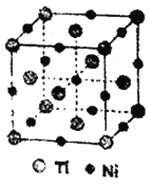
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应 5H2C2O4+2MnO4 -+6H+ = 10CO2↑+ 2Mn2+ + 8H2O 为例探究“外界条件对化学反应速率的影响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。下列说法不正确的是

A. 实验①、 ②、 ③所加的H2C2O4 溶液均要过量
B. 实验①和实验②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响
C. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
D. 若实验①测得 KMnO4溶液的褪色时间为40s,则这段时间内平均反应速率 v(KMnO4)= 2. 5×10-4 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.由H原子形成1molH﹣H键要吸收热量
B.所有燃烧反应都是放热反应
C.在稀溶液中,1mol酸与1mol碱发生中和反应生成水时所释放的热量称为中和热
D.凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2互为等电子体的化合物 .
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列 .
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 .
(4)Se原子基态核外电子的排布式为;H2Se的沸点:﹣41.1℃,H2S的沸点:﹣60.4℃引起两者沸点差异的主要原因是 .
(5)SO32﹣离子中硫原子的杂化方式 , 该离子的立体构型为 .
(6)金属元素Ca的氧化物用作玻璃、瓷器的颜料、脱硫剂.其立方晶体的晶胞结构如图所示,已知Ca2+的半径为r1cm,O2﹣的半径为r2cm,该晶胞密度为ρgcm﹣3 , 阿伏伽德罗常数用NA表示,则该晶胞中离子体积占晶胞体积百分率为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒中的新药。合成丁苯酞(J) 的一种路线如下:
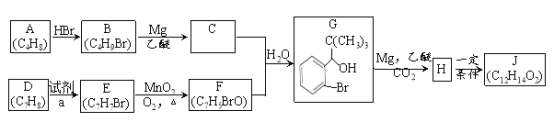
已知: 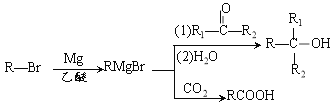
回答下列问题:
(1)A的名称是______________________________。
(2)B生成A的化学方程式____________________________。
(3) D生成E的反应类型为_____________,试剂a是_______________________。
(4) F 的结构简式__________________________。
(5)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J 的化学方程式___________。
(6)![]() X,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X 的同分异构体共有_____种。
X,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X 的同分异构体共有_____种。
(7)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成![]() 路线流程图(其它试剂自选)。________________________________。
路线流程图(其它试剂自选)。________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中轴表示实验时流入正极的电子的物质的量, y轴表示

A. 铜棒的质量 B. c(H+) C. c(SO42-) D. c(Zn2+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com