
 。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形,属于极性分子。
。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形,属于极性分子。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源:不详 题型:单选题
| A.第三周期VIII族,P区 |
| B.第三周期VB族,ds区 |
| C.第四周期VIII族,d区 |
| D.第四周期VB族, f区 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
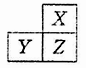
| A.原子半径:X<Y<Z |
| B.气态氢化物的热稳定性:X>Z>Y |
| C.y和z的最高价氧化物对应水化物均为强酸 |
| D.若z的最高正价为+m,则X的最高正价也一定为+m |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.n+11 | B.n-5 | C.n+3 | D.n-6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
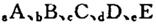 元索,
元索,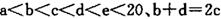 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。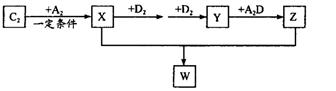

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 |
| B.可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 |
| C.由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 |
| D.在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com