
| A. | 金刚石、石墨 | B. | H、D、T | C. | 1940K、2040Ca | D. | O2、O3 |
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 在制备乙烯的实验中,加热时应使温度缓慢上升至170°C | |
| B. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| C. | 将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg | B. | 热稳定性:HCl>H2S | ||
| C. | 酸性强弱:H2SiO3<H2CO3 | D. | 碱性强弱:NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.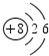 若一个B原子中有8个中子,写出B的原子符号168O.
若一个B原子中有8个中子,写出B的原子符号168O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为-285.5kJ/mo1,则电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5kJ/mo1 | |
| B. | 1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,则它的热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1)△H=-445kJ/mol | |
| C. | 已知:2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热为-110.5kJ/mo1 | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com