
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
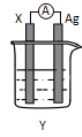
(1)电极X的上发生的电极反应为______反应(氧化或还原);电解质溶液Y是________;
(2)银电极为电池的_____极,发生的电极反应式为_______;
(3)外电路中的电子__________(填“流出”或“流向”)Ag电极。
(4)当有1.6 g铜溶解时,银棒增重______ g。
(5)现有如下两个反应:(A))NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2
①根据两反应本质,分别判断能否用于设计原电池,如果不能,说明其原因_______________。
②如果可以,写出正极反应式:___________。
【答案】氧化反应AgNO3溶液正Ag++eˉ=Ag流向5.4A不是自发的氧化还原反应Fe3++eˉ=Fe2+
【解析】
(1)根据反应方程式,电极X为Cu,Cu的化合价升高,即电解X为负极,则电极X上发生氧化反应,该反应是Cu和Ag+反应,因此电解质溶液为AgNO3溶液;(2)根据(1)的分析,电极X为负极,则Ag电极为正极,Ag+在正极上得电子,即正极反应式为Ag++e-=Ag;(3)根据原电池的工作原理,电子从负极经外电路流向正极,即从Cu电极经外电路流向Ag电极;(4)负极电极反应式Cu-2e-=Cu2+,根据通过电子相等,建立Cu~2Ag,1.6gCu被消耗,即消耗1.6/64mol=0.025molCu,则生成Ag的质量为2×0.025×108g=5.4g;(5)①A、没有化合价的变化,不属于氧化还原反应,B、存在化合价的变化,属于氧化还原反应,原电池的实质是氧化还原反应,因此A不能设计成原电池;②B能设计成原电池,Fe的化合价升高,即Fe为负极,则正极反应式为Fe3++e-=Fe2+。


科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属。工业上常用硫酸酸解钛铁矿(主要成分为FeTiO3,还含有部分Fe2O3)的方法制取金红石(TiO2),再还原TiO2制取金属钛。工业制取TiO2的工艺流程图如下:

回答下列问题:
(1)钛酸亚铁(FeTiO3)中Ti的化合价为________________________。
(2)钛液1中钛以TiO2+的形式存在,则FeTiO3与硫酸反应的离子方程式为________。
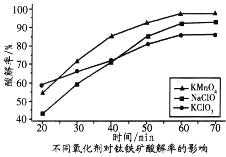
(3)为提高钛铁矿的酸解率,可添加适量氧化剂,依据右图判断,添加的最佳氧化剂为_____________(填化学式)。
(4)钛液1中加入的A物质是____________,流程中的操作a是____________。
(5)制取金红石过程中,需要测定TiO2+的含量。取100mL钛液1,加铝粉,使其发生反应3TiO2++Al+6H+=3Ti3++Al3++3H2O,反应消耗铝1.35g,则钛液1中TiO2+的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法的是
A.合金具有优良性能,可用于制造新型金属材料
B.氧化铁俗称铁红,可用作红色油漆和外墙涂料
C.二氧化硫具有漂白性,常用来漂白食品
D.A12O3可用作耐高温材料,A1(OH)3可用于中和过多的胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是
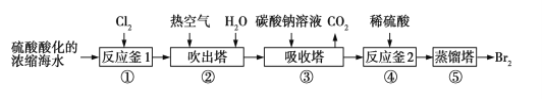
A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑
D. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C2H4O2的有机化合物A具有如下性质:
①A+Na → 迅速产生气泡;
②A+CH3CH2OH ![]() 有香味的物质。
有香味的物质。
(1)根据上述信息,对该化合物可做出的判断是_________(填字母)。
A.一定含有—OH B.一定含有—COOH
C.有机化合物A为乙醇 D.有机化合物A为乙酸
(2)A与金属钠反应的化学方程式为_____________
(3)化合物A和CH3CH2OH反应生成的有香味的物质的结构简式为_______________。
(4)有机化合物B的分子式为C2H4O3,与Na反应迅速产生H2,且1 mol B与足量Na反应放出1 mol H2,则B的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与B反应生成C,假定反应由A、B开始,它们的初始浓度均为1.0mol·L-1。反应进行2min后A的浓度为0.8 mol·L-1,B的浓度为0.6 mol·L-1,C的浓度为0.6 mol·L-1。
⑴2min内的平均速率为V(A)=_________,V(B)=________,V(C)=________;
⑵V(A):V(B):V(C)=___________________;
⑶该反应的化学方程式为:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都属于元素周期表中前20号元素,原子序数依次增大。元素周期表中A的电负性最大,B是同周期元素中第一电离能最小的元素,A、D同主族,B、C、D同周期,E是人体的必需元素,缺乏时易引起佝偻病,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)A、D分别可形成简单气态氢化物,其中沸点较低的是____(填化学式),原因是_____。
(2)C元素原子的价电子排布图为____。
(3)B能与氧气反应生成过氧化物,写出与O22-互为等电子体的一个分子和一个离子的化学式_____、________。
(4)CO能与B和Mn形成B[Mn(CO)5],配体是____。
(5)D和铯与不同价态的铜生成两种化合物,其阴离子均为无限长链结构如图所示,a位置上的D原子的杂化轨道类型为_________。已知其中一种化合物的化学式为CsCuD3,则另一种的化学式为_________(用元素符号表示)。

(6)EA2的晶胞如图所示,若晶胞边长为x pm,则晶胞密度为____g/cm3(用NA和x表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法命名。
①有机物CH3CH(C2H5)CH(CH3)2的名称是________________________。
②(CH3)2CHCH(CH3)CH2CH2Br的名称是__________________________。
(2)写出下列各有机物的结构简式。
①2,3-二甲基-4-乙基已烷___________________________________。
②支链只有一个乙基且式量最小的烷烃______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com