
【题目】H、C、N、O都属于自然界中常见的非金属元素。
(1)O、C、N三种元素的第一电离能最大的元素的基态原子价电子的轨道表达式(即电子排布图)为 ,p轨道按该排列的原理是 。
(2) O22+与N2互为等电子体,则O22+中![]() 键数目和
键数目和![]() 键数目之比为 。
键数目之比为 。
(3)N元素常形成两种含氧酸,NO2-中N原子的杂化类型是 ;NO2-的空间构型是 ,硝酸沸点不高的原因可能是 。(简答两条)
(4)Co2+在水溶液中以[Co(H2O)6]2+形式存在,向含Co2+的溶液中加入氨水,可生成[Co(NH3)6]2+,[Co(NH3)6]2+更稳定的原因是 。
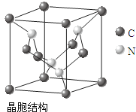
(5)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,则该晶体为___________晶体,若晶胞边长为acm,则该晶体的密度为 g/cm3(只需列算式,不必计算出数值,阿伏伽德罗常数的值为NA)。
【答案】
(1)![]() ;洪特规则;
;洪特规则;
(2)1:2 ;
(3)sp2;V形;HNO3是分子晶体,易形成分子内氢键;
(4)N的电负性小于O,更易提供孤对电子形成配位键;
(5)原子;92/a3NA
【解析】
试题分析:(1) 同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;电离能最大的元素为N,基态原子价电子的轨道表达式为![]() ,p轨道按该排列的原理洪特规则,故答案为:
,p轨道按该排列的原理洪特规则,故答案为:![]() ;洪特规则;
;洪特规则;
(2) O22+与N2互为等电子体,则O22+中含有1个![]() 键和2个
键和2个![]() 键,数目之比为1:2,故答案为:1:2;
键,数目之比为1:2,故答案为:1:2;
(3) NO2-中N原子的价层电子对数=2+![]() (5+1-2×2)=3,杂化类型是sp2,含有1个孤电子对,NO2-的空间构型是V型;HNO3是分子晶体,易形成分子内氢键,使沸点降低,故答案为:sp2;V形;HNO3是分子晶体,易形成分子内氢键;
(5+1-2×2)=3,杂化类型是sp2,含有1个孤电子对,NO2-的空间构型是V型;HNO3是分子晶体,易形成分子内氢键,使沸点降低,故答案为:sp2;V形;HNO3是分子晶体,易形成分子内氢键;
(4) N的电负性小于O,更易提供孤对电子形成配位键,因此向含Co2+的溶液中加入氨水,可生成[Co(NH3)6]2+,故答案为:N的电负性小于O,更易提供孤对电子形成配位键;
(5)根据该晶体硬度超过目前世界上最硬的金刚石,可知该晶体为原子晶体;该晶体晶胞中含有C原子8×![]() +4×
+4×![]() =3,N原子数为4,化学式为C3N4,1mol晶体的质量为92g,1mol晶胞的体积为NA a3cm3,因此该晶体的密度为
=3,N原子数为4,化学式为C3N4,1mol晶体的质量为92g,1mol晶胞的体积为NA a3cm3,因此该晶体的密度为![]() =
=![]() g/cm3,故答案为:原子;
g/cm3,故答案为:原子;![]() 。
。


科目:高中化学 来源: 题型:
【题目】
Ⅰ.写出碳酸氢钠和次氯酸在水溶液中的电离方程式 、 。
Ⅱ.某无色透明溶液中可能大量存在Ag+、Al3+、Cu2+、Fe3+、Na+中的几种,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______________。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有___________,有关的离子方程式为______________________。
(4)原溶液可能大量存在的阴离子是下列的___________。
A.Cl- B.NO![]()
C.CO![]() D.OH-
D.OH-
(5)请设计实验证明原溶液中有钠离子(写出详细实验操作过程及现象) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定气体体积大小的主要因素是( )
①气体分子的数目 ②气体分子的直径 ③气体分子间的距离 ④气体分子的质量
A.①② B.②③ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是

A. 该反应在T1、T3温度时达到过化学平衡 B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应 D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.铵盐化学性质都很稳定
B.锌片与稀硝酸反应可制得氢气
C.雷雨天气时空气中能生成少量的氮氧化物
D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速退去,其离子方程式为(未配平):
MnO4-+H2C2O4+H+→CO2+Mn2++![]() ,下列有关叙述正确的是
,下列有关叙述正确的是
A.该反应的氧化剂为H2C2O4
B.该离子方程式右侧方框内的产物是OH-
C.6mol H+参加反应时,电子转移10mol
D.每生成1mol CO2,电子转移的数目为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 纯碱、烧碱均属于碱 B. SiO2、SO2均属于酸性氧化物
C. 凡能电离出H+的化合物均属于酸 D. 盐类物质一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水(酸性)中的有机物可用C6H10O5表示[交换膜分别是只允许阴(阳) 离子通过的阴(阳)离子交换膜],下列有关说法中不正确的是
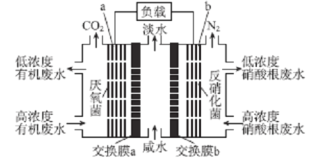
A.电池工作时,电子由a极经导线流向b极
B.交换膜a是阴离子交换膜
C.电极 b 的反应式:2NO3-+l0e-+12H+=N2↑+6H2O
D.相同时间内(相同状况下)生成CO2和N2的体积比为2:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com