
分析 (1)①氯化氢为强电解质,溶于水完全电离出氢离子、氯离子;
②氢氧化钡为二元强碱,一步完全电离出钡离子、氢氧根离子;
③碳酸氢钠属于强电解质,完全电离出钠离子和碳酸氢根离子;
④NaHSO4是强酸强碱酸式盐,完全电离出钠离子和硫酸根离子、氢离子;
(2)根据m=nM计算而质量,根据N=nNA计算分子数目,结合分子含有的氧原子数目计算氧原子的物质的量.
解答 解:(1)①氯化氢为强电解质,完全电离,电离方程式:HCl=H++Cl-,
故答案为:HCl=H++Cl-;
②氢氧化钡为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-;
③碳酸氢钠属于强电解质,溶液中完全电离,碳酸为弱酸,碳酸氢根离子不能拆写,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
④NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO42-离子,电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-;
(2)0.3mol的氧气的质量为0.3mol×32g/mol=96g,含有分子数目为0.3mol×NAmol-1=0.3NA,含有氧原子为0.3mol×2=0.6mol;
0.2mol的臭氧(O3)的质量=0.2mol×48g/mol=96g,含有分子数目为0.2mol×NAmol-1=0.2NA,含有氧原子为0.2mol×3=0.6mol,
故二者质量相等,分子数目不相等,含有原子数目相等,
故答案为:相等;不相等; 相等.
点评 本题考查了电解质电离方程式的书写、物质的量有关计算,明确电解质强弱及电离方式是解题关键,注意电离方程式遵循原子个数、电荷数守恒规律,题目难度不大.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀有气体不活泼是因为它们原子最外层都达到8e-稳定结构 | |
| B. | 原子序数为12的元素位于元素周期表的第三周期ⅡA族 | |
| C. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 | |
| D. | ⅦA族元素是同周期主族元素中原子半径最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.1mol•L-1的稀硫酸中含有SO42-个数为0.1NA | |
| B. | 含1 mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2 NA | |
| C. | 4℃时,5.4mL水中所含的水分子数是0.3NA | |
| D. | 标准状况下,22.4L氢气所含的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.0L 0.5mol•L-1NaCl溶液 | B. | 1.0L 0.3mol•L-1Na2SO4溶液 | ||
| C. | 5.0L 0.4mol•L-1NaOH | D. | 2L 0.15mol•L-1Na3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | |
| ② | KMnO4 | H2O2 | O2 | MnO2 |
| ③ | KClO3 | 浓盐酸 | Cl2 | |
| ④ | KMnO4 | 浓盐酸 | Cl2 | MnCl2 |
| A. | 表中①反应的氧化产物只能有FeCl3 | |
| B. | 表中②生成1mol的O2将有4mol的电子转移 | |
| C. | 还原性比较:H2O2>Mn2+>Cl- | |
| D. | 表中④的离子方程式配平后,H+的化学计量数为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
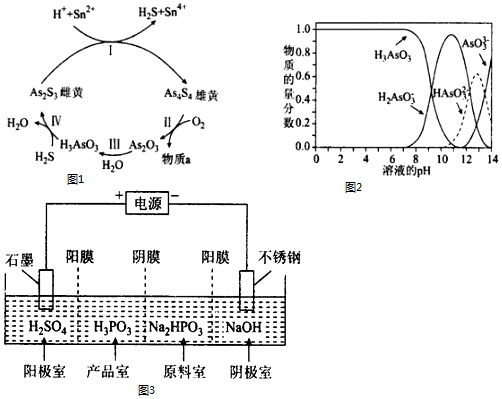
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
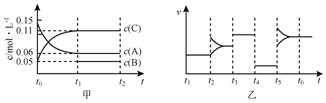
| A. | 若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段容器内A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-100akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少5个原子同在一条直线上 | B. | 所有的原子在一个平面上 | ||
| C. | 4个碳原子同在一条直线上 | D. | 4个氢原子不在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com