
【题目】高铁酸钾(K2FeO4)具有强氧化性,是一种新型多功能水处理剂,其生产工艺流程如下:
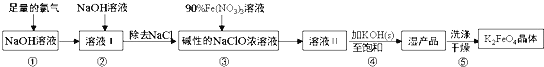
已知:K2FeO4在水溶液中易发生反应:4FeO42+10H2O4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是( )
A.步骤③中氧化剂与还原剂的物质的量之比为3:2
B.步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小
C.步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制
D.配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒、胶头滴管等
【答案】D
【解析】
足量Cl2通入NaOH溶液中,温度较低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入NaOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下ClO-才能和Fe3+发生氧化还原反应生成FeO42-,除去NaCl得到碱性的NaClO浓溶液,向碱性的NaClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,向溶液中加入KOH固体至饱和,得到K2FeO4,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4。
A.步骤③发生的反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,Fe3+是还原剂、ClO-是氧化剂,所以氧化剂和还原剂的物质的量之比为3:2,A正确;
B.步骤④中Na2FeO4转变为湿产品时,是利用溶解度大的物质转化为溶解度小的物质,步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小,B正确;
C.醋酸钾是强碱弱酸盐,水解使溶液呈碱性,能抑制高铁酸根离子水解,异丙醇能降低高铁酸钾溶解性且防止其水解,所以骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制,C正确;
D.配制一定质量分数的溶液不需要容量瓶,需要烧杯、玻璃棒和量筒,D错误;
故合理选项是D。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】以下化学反应的离子方程式书写正确的是( )
A. H2CO3电离:H2CO3![]() CO32-+2H+
CO32-+2H+
B. 将少量金属钠放入冷水中:Na+2H2O=Na+ +2OH-+H2↑
C. C12溶解于水:Cl2+H2O![]() 2H++ClO- +Cl-
2H++ClO- +Cl-
D. 向CuSO4溶液中通入H2S:Cu2+ +H2S=CuS↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是有机合成工业中一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3+6Cl2![]() 4AlCl3+3O2。
4AlCl3+3O2。
(1)实验室制氯气的离子方程式为_________________________氯气溶于水生成的次氯酸的电子式为__________________________
(2)AlCl3可以作净水剂,其原理是(用离子方程式表示) ___________________________
(3)Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其离子方程式为________________
(4)为分析某铝合金的成分,用足量稀硝酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为5、9时过滤沉淀,继续滴加NaOH溶液无沉淀生成。结合图象信息推断该合金中除铝外还含有的金属是___________________________。
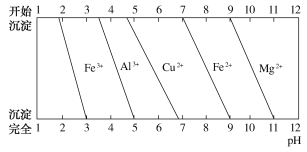
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中氧化剂是__________,还原剂是__________,请用双线桥表示电子转移数目_________________。当有l mol Cl2生成时,氧化剂与还原剂的物质的量之比为____________。
(2)3NO2 + H2O = 2HNO3 + NO中当电子转移4mol时,参加还原反应的NO2有__________mol,氧化产物与还原产物物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为CO(g)+2H2(g)=CH3OH(g) ΔH=-116kJ·mol-1。某些化学键的键能数据如表:
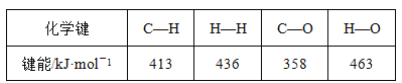
则CO中碳氧键的键能是
A.431kJ·mol-1B.946kJ·mol-1
C.1072kJ·mol-1D.1130kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.6gCu和Cu2O组成的混合物加入250 mL一定浓度的稀硝酸中,固体完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0 L 0.5 molL-1的NaOH溶液,生成沉淀的质量为19.6 g,此时溶液呈中性,且金属离子(钠离子除外)沉淀完全。下列说法正确的是( )
A.原固体混合物中,Cu和Cu2O的物质的量之比为1:1
B.原稀硝酸的浓度为2.4 mol·L-1
C.固体溶解后剩余硝酸的物质的量为0.05 mol
D.产生的NO的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)Ⅲ中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是
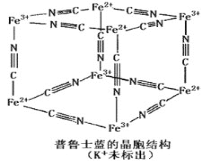
A. 化学式可以表示为KFe2(CN)6
B. 每一个立方体中平均含有24个π键
C. 普鲁士蓝不属于配位化合物
D. 每个Fe3+周围与之相邻的Fe2+离子有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中碘含量比较高,从海带提取碘的操作如下:
(1)将干海带进行灼烧的仪器是________,海带灰中含有较多KI,将海带灰溶于水,然后过滤得到澄清滤液。
(2)向上述滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。请写出离子反应方程式:________________________________。
(3)向上述碘的水溶液中加入适量CCl4,振荡,静置,则I2会转入到CCl4层中,这个过程叫_____________________,现象为____________________________。
(4)3I2+6KOH=5KI+KIO3+3H2O;1.5mol I2完全反应转移电子的物质的量为_____mol;氧化剂与还原剂的物质的量之比为___________。
(5)某一反应体系有反应物和生成物共6种物质:O2、K2Cr2O7、Cr2(SO4)3、H2SO4、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中,氧化剂为____________。氧化产物为____________。
②写出该反应的化学方程式__________________________。
③用单线桥法表示上述反应中电子转移方向和数目________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com