
【题目】N和Si是合成新型非金属材料的两种重要元素.请回答:
(1)基态Si原子的价层电子排布图为;其2p能级的轨道有个伸展方向,电子云的形状为 .
(2)Si原子可形成多种氢化物,其中Si2H4中Si原子的价层电子对数目为 , Si原子的杂化轨道类型为 .
(3)N和Si形成的原子晶体中,N原子的配位数为 .
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色.大多数金属元素有焰色反应的微观原因为;N3﹣中σ键和π键的数之比为 . B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为(用元素符号表示).
(5)NaNO2是一种重要的工业原料,NO2﹣的空间构型为 .
(6)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成. 
则:①晶胞中最小的环含有个原子.
②若晶体密度为ρgcm﹣3 , 阿伏伽德罗常数为NA , 晶胞中两个最近的Si原子核之间的距离为pm(用代数式表示).
【答案】
(1)![]() ;3;纺锤形
;3;纺锤形
(2)3;sp2
(3)3
(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;1:1;F>N>B
(5)V形
(6)12;![]() ×1010
×1010
【解析】解:(1)Si为14号元素,价层电子排布图为 ![]() ,2p能级的轨道有3个伸展方向,电子云的形状为纺锤形,所以答案是:
,2p能级的轨道有3个伸展方向,电子云的形状为纺锤形,所以答案是: ![]() ;3;纺锤形;(2)Si2H4中Si原子的价层电子对数目=3且不含孤电子对,其结构和乙烯相似,根据价层电子对互斥理论判断Si原子杂化方式为sp2 , 所以答案是:3;sp2;(3)N和Si形成的原子晶体化学式为Si3N4 , 该物质中每个N原子只能形成3个共价键,所以每个N原子配位数是3,所以答案是:3;(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以大多数金属焰色反应时呈现一定颜色;N3﹣与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键,则N3﹣中σ键和π键的数之比为1:1;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是F>N>B,
;3;纺锤形;(2)Si2H4中Si原子的价层电子对数目=3且不含孤电子对,其结构和乙烯相似,根据价层电子对互斥理论判断Si原子杂化方式为sp2 , 所以答案是:3;sp2;(3)N和Si形成的原子晶体化学式为Si3N4 , 该物质中每个N原子只能形成3个共价键,所以每个N原子配位数是3,所以答案是:3;(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以大多数金属焰色反应时呈现一定颜色;N3﹣与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键,则N3﹣中σ键和π键的数之比为1:1;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是F>N>B,
所以答案是:电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;1:1;F>N>B;(5)NO2﹣中N价层电子对个数=2+ ![]() =3且含有一个孤电子对,根据价层电子对互斥理论判断亚硝酸根离子空间构型为V形,
=3且含有一个孤电子对,根据价层电子对互斥理论判断亚硝酸根离子空间构型为V形,
所以答案是:V形;(6)①根据图知,每个最小环上含有6个Si原子、6个O原子,所以晶胞中最小的环含有12个原子,所以答案是:12;
②金刚石晶胞中4个C原子在晶胞内部,6个C原子在面心上、8个C原子分别位于8个顶点上,所以该晶胞中C原子个数=4+8× ![]() +6×
+6× ![]() =8,该晶胞体积=
=8,该晶胞体积= ![]() cm3 , 晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的
cm3 , 晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的 ![]() =
= ![]() ×
× ![]() ×
× ![]() cm=
cm= ![]() ×
× ![]() ×
× ![]() cm=
cm= ![]()
![]() cm=
cm= ![]()
![]() ×1010pm,
×1010pm,
所以答案是: ![]()
![]() ×1010 .
×1010 .


科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH ![]() +6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
+6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容、充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察 .
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色.
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.101 0molL﹣1 , 则该样品中氮的质量分数为(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,能正确反映醋酸与氧化钠反应的离子方程式( )
A.CH3COOH+OH﹣═CH3COO﹣+H2O
B.H++OH﹣═H2O
C.CH3COOH+OH﹣+Na+═CH3COONa+H2O
D.CH3COOH+NaOH═CH3COO﹣+Na++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Si3N4是一种重要的新型无机非金属材料,能被强碱腐蚀;实验室可利用SiCl4蒸气和NH3在1400℃、无水、无氧条件下反应制取氧化硅,实验装置示意图(加热和夹持装置略去)和有关性质如下: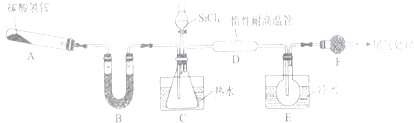
物质 | 熔点/℃ | 沸点/℃ | |
SiCl4 | ﹣70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
Si3N4 | 1900 | ﹣ | 性质稳定 |
请回答下列问题:
(1)装置B中所加入的试剂名称为 .
(2)装置C中的锥形瓶需要热水浴,热水浴加热的优点为 .
(3)反应开始前先组装好仪器,(填操作步骤)后,再加装药品,接下来的操作是(请按正确的顺序填写下列步骤的序号).
①滴加SiCl4②加热装置D ③加热装置A
(4)装置D中发生反应的化学方程式为 .
(5)反应过程中,装置E中的现象为 .
(6)测定产品中 Si3N4的含量,步骤为:
ⅰ.反应结束后,取200.0g装置D中的物质,加入足量NaOH溶液,充分加热反应;
ⅱ.将生成的气体全部被200.0mL3.000molL﹣1盐酸吸收(溶液体积变化忽略不计);
ⅲ.取吸收后所得溶液20.00mL,用0.2500molL﹣1NaOH溶液滴定过量盐酸;
ⅳ.重复滴定3次,平均消耗NaOH溶液32.00mL.
①步骤ⅰ中发生反应的离子方程式为 .
②产品中Si3N4的质量分数为(保留3位有效数字)
(7)Si3N4抗腐蚀能力很强,但易被氢氟酸腐蚀,反应生成四氟化硅和一种铵盐,该盐的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含以下种类物质:压缩气体天然气、易燃液体甲醇、乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等.
(1)由于CaC2、金属钠、金属钾以及固体NaH等物质能够跟水反应给灾后救援工作带来了很多困难.如果在实验室,你处理金属钠着火的方法是(填序号);
A.泡沫灭火器 B.消防车喷水 C.沙土
其中固体NaH与水反应的方程式为 .
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤.
①其水溶液呈强碱性,故俗称硫化碱.
②其水溶液在空气中会缓慢地氧化成Na2S2O3 , 该反应中还原剂与氧化剂物质的量之比为
(3)以上易燃液体甲醇是一种可再生能源,具有开发和应用的广阔前景,如: 
①2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图1所示.
该电池正极的电极反应式为;负极的电极反应式;工作一段时间后,当6.4g甲醇完全反应生成CO2时,有个电子发生转移.
②以上述电池做电源,用图2所示装置模拟氯碱工业,若只有铝棒和碳棒两个电极,则与电源负极相连的是(填铝棒或碳棒);试写出电解该溶液总反应化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔浓度相同的三种盐NaX,NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX,HY,HZ的酸性由强到弱的顺序是( )
A.HX,HZ,HY
B.HZ,HY,HX
C.HX,HY,HZ
D.HY,HZ,HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中正确的是( ) 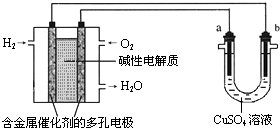
A.燃料电池工作时负极反应为:H2=2H++2e﹣
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com