
【题目】乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:CH3COOH+CH3CH2CH2CH20H ![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
制备过程中还可能有的副反应有
2CH3CH2CH2CH2OH ![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O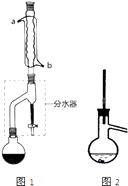
主要实验步骤如下:
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4 , 摇匀后,加几粒沸石,再按图1示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离与提纯:
①将烧瓶中反应后的混后物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/gmL﹣1 | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
根据以上信息回答下列问题:
(1)如图1整个装置可看作由分水器、圆底烧瓶和(填仪器名称)组成,其中冷水应从(填a或b)管口通入.
(2)如何判断该合成反应达到了终点: .
(3)在操作步骤①时,用右手压住分液漏斗的玻璃塞,左手握住将分液漏斗倒转过来,用力振荡,振摇几次后要放气,放气时支管口不能对着人和火.在操作步骤②后(即酯层用无水硫酸镁干燥后),应先(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在中加热比较合适(请从下列选项中选择).A.水 B.甘油(沸点290℃) C.砂子 D.石蜡油(沸点200~300℃)
如果蒸馏装置如图2所示,则收集到的产品中可能混有杂质.
(5)反应结束后,若放出的水为6.98mL(水的密度为1gmL﹣1),则正丁醇的转化率约为 .
【答案】
(1)冷凝管;b
(2)分水器中水面不再升高
(3)旋塞;过滤
(4)BD;正丁醚
(5)88%
【解析】解:(1)由装置图可知,装置由分水器、圆底烧瓶和冷凝管组成;冷凝管中的冷凝水应该从下口进上口出,所以从b管口通入;所以答案是:冷凝管;b;(2)加热反应时会有少量正丁醇挥发进入分水器,分水器的液面会升高,当反应完全时,不再有正丁醇挥发进入分水器,则分水器中的液面不再升高,则合成反应达到了终点;所以答案是:分水器中水面不再升高;(3)振荡分液漏斗时,右手压住分液漏斗的玻璃塞,左手握住旋塞,用力振荡;在操作步骤②后(即酯层用无水硫酸镁干燥后),应先把固液混合物分离,即通过过滤分离出乙酸丁酯,再把乙酸丁酯再转入蒸馏烧瓶;所以答案是:旋塞;过滤;(4)乙酸正丁酯的沸点为126.1℃,选择沸点稍高的液体加热,所以可以在甘油和石蜡油中加热,水的沸点为100℃,加热温度太低,用砂子加热温度太高不易控制;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,正丁醚与乙酸丁酯互溶,水洗和10%碳酸钠溶液洗时不能除去,所以蒸馏时会有少量挥发进入乙酸丁酯,则乙酸正丁酯的杂质为正丁醚;所以答案是:BD;正丁醚;(5)反应结束后,若放出的水为6.98mL(水的密度为1gmL﹣1),则反应生成的水为6.98mL﹣5.00mL=1.98mL,即1.98g,设参加反应的正丁醇为xg,CH3COOH+CH3CH2CH2CH20H ![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
74 18
xg 1.98g
则x= ![]() =8.14g,
=8.14g,
则正丁醇的转化率约为 ![]() ×100%=88%;所以答案是:88%.
×100%=88%;所以答案是:88%.


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol?L﹣1 NaOH溶液:K+、Ba2+、Cl﹣、HCO ![]()
B.0.1 mol?L﹣1 Na2CO3溶液:K+、NH ![]() 、NO
、NO ![]() 、SO
、SO ![]()
C.0.1 mol?L﹣1 FeCl3溶液:K+、Na+、I﹣、SCN﹣
D.0.1 mol?L﹣1 HCl的溶液:Ca2+、Na+、ClO﹣、NO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A | 在恒容密闭容器中,可逆反应C(s)+H2O(g) | 正反应选率将逐渐增大 |
B | 比较硅和碳的还原性 | 利用反应:SiO2+2C |
C. | 氯气具有漂白性 | 氯气通入滴有酚酞的NaOH溶液,溶液褪色 |
D | 证明氯气与水反应生成酸性物质,且该反应为可逆反应 | 少量氯气通入大量水中,测定溶液pH<7且显浅黄绿色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法不正确的是
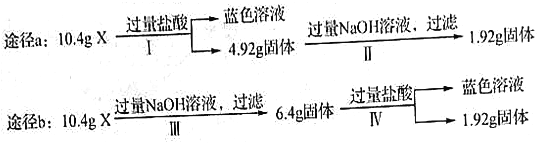
A. 由图可知X中可能存在Fe2O3 B. 可以判断混合物中是否含有Al2O3
C. 1.92g固体成分为Cu D. 依图可以计算Fe2O3和Cu的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
B.乙醇、乙烯、乙醛都能使酸性高锰酸钾溶液褪色
C.豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定
D.核电站泄漏的放射性碘﹣131( ![]() I)、铯﹣137(
I)、铯﹣137( ![]() Cs)互称同位素,可使蛋白质变性
Cs)互称同位素,可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)═3Ag2O(s)△H=﹣235.8kJ/mol.
已知2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ/mol,
则常温下反应:2O3(g)═3O2(g)的△H= .
(2)科学家首先使用在酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,电极反应式为3H2O﹣6e﹣=O3↑+6H+ , 阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 .
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8并生成氧气.写出该反应的化学方程式:
(4)所得的Na2S2O8溶液可降解有机污染物4﹣CP.原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4﹣).通过测定4﹣CP降解率可判断Na2S2O8溶液产生SO4﹣的量.某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4﹣的影响.①溶液酸碱性的影响:其他条件相同,将4﹣CP加入到不同pH的Na2S2O8溶液中,结果如图a所示.由此可知:溶液酸性增强,(填“有利于”或“不利于”)Na2S2O8产生SO4﹣ . 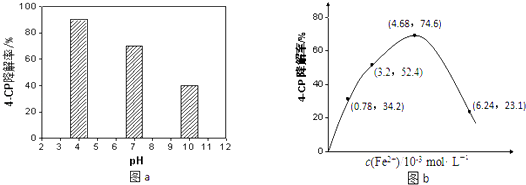
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4﹣CP)=1.56×10﹣4molL﹣1、c(Na2S2O8)=3.12×10﹣3 molL﹣1的混合溶液中.反应240min后测得实验结果如图b所示.已知 S2O82﹣+Fe2+═SO4﹣+SO42﹣+Fe3+ . 则由图示可知下列说法正确的是:(填序号)
A.反应开始一段时间内4﹣CP降解率随Fe2+浓度的增大而增大,原因是Fe2+能使Na2S2O8产生更多的SO4ˉ.
B.Fe2+是4﹣CP降解反应的催化剂
C.当c(Fe2+)过大时,4﹣CP降解率反而下降,原因可能是Fe2+会与SO4﹣发生反应,消耗部分SO4﹣.
D.4﹣CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于4﹣CP的降解.
③当c(Fe2+)=3.2×10ˉ3molL﹣1时,4﹣CP降解的平均反应速率的计算表达式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com