
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与澄清石灰水反应 | ||
| C. | NaHCO3与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
分析 A.Ca(HCO3)2与NaOH按照物质的量之比为2:3反应生成碳酸钙、碳酸钠、碳酸氢钠和水;
B.碳酸氢钙与氢氧化钙反应生成碳酸钙和水;
C.NaHCO3与氢氧化钙按照物质的量之比为3:2反应生成碳酸钙、碳酸钠、氢氧化钠和水;
D.NH4HCO3与澄清石灰水反应二者反应生成碳酸钙、一水合氨和水;
解答 解:A.Ca(HCO3)2与NaOH按照物质的量之比为2:3反应生成碳酸钙、碳酸钠、碳酸氢钠和水,离子方程式:2Ca2++3HCO3-+3OH-→2CaCO3↓+CO32-+3H2O,故A正确;
B.Ca(HCO3)2与澄清石灰水反应,离子方程式:Ca2++HCO3-+OH-→2aCO3↓+H2O,故B错误;
C.NaHCO3与氢氧化钙按照物质的量之比为3:2反应生成碳酸钙、碳酸钠、氢氧化钠和水,离子方程式为:2Ca2++3HCO3-+3OH-→2CaCO3↓+CO32-+3H2O,故C正确;
D.NH4HCO3与澄清石灰水反应二者反应生成碳酸钙、一水合氨和水,离子方程式:NH4++HCO3-+Ca2++2OH-=NH3•H2O+CaCO3↓+H2O,故D错误;
故选:AC.
点评 本题考查了离子方程式的书写,侧重考查与反应物用量有关的离子反应,明确反应实质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

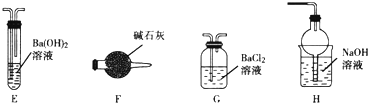
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
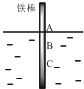 如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )
如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )| A. | 该腐蚀过程属于电化腐蚀 | |
| B. | 铁棒AB段电极反应为O2+2H2O+4e→4OH- | |
| C. | 铁棒AB段是负极,BC段是正极 | |
| D. | 产生此现象的根本原因是铁棒所处化学环境的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
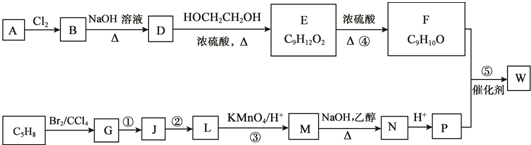
 .
. ;D中含氧官能团的名称是羟基;④的反应类型是消去反应.
;D中含氧官能团的名称是羟基;④的反应类型是消去反应.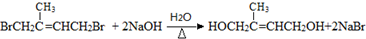 .
. .
.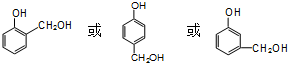 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
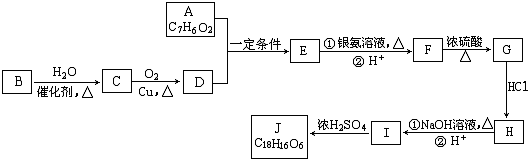
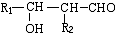
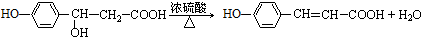 .
.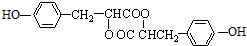 .
.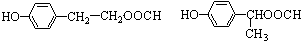 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| B. | 电解熔融氧化铝、粗硅的制取、生物炼铜、煤焦油中提取苯等过程都涉及化学变化 | |
| C. | 从2016年1月1号开始浙江省汽油标准由“国Ⅳ”提高到“国V”,但这并不意味着汽车不再排放氮氧化物 | |
| D. | 纳米技术、分子设计技术的发展,将使分子晶体管、分子芯片、分子导线、分子计算机等化学器件得到广泛的应用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
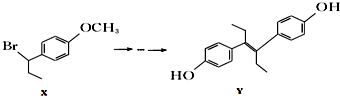
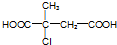
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com