
【题目】下列说法正确的是( )
A.60 g SiO2中含Si—O键的个数为4NA
B.12 g金刚石中含有C—C键的个数为NA
C.金属Mg比金属Cu的空间利用率大
D.邻羟基苯甲醛(![]() )比对羟基苯甲醛(
)比对羟基苯甲醛(![]() )的沸点高
)的沸点高
科目:高中化学 来源: 题型:
【题目】SnCl4是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,下图采用微型实验进行SnCl4 的制备,解决了常规方法的弊端(己知:SnCl4的熔点为-33℃,沸点为114.1℃)。
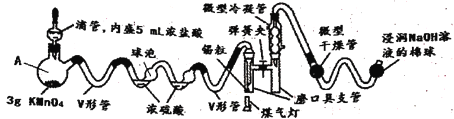
(1)将已干燥的各部分仪器按图连接好后,需要进行的操作为________________________。
(2)V形管的作用是________________________________________________________。
(3)下列说法中正确的是_____
A.仪器A的名称为蒸馏烧瓶
B.为了充分干燥氯气,浓硫酸的体积应大于球泡的体积
C.操作时应先滴加浓盐酸,使整套装置内充满黄绿色气体,再用煤气灯加热
D.生成的SnCl4蒸气经冷却聚集在磨口具支管中
E.微型干燥管中的试剂可以是碱石灰、五氧化二磷或无水氯化钙等
(4)实验中0.59锡粒完全反应制得1.03g SnCl4,则该实验的产率为_____________(计算结果保留一位小数)。
(5)SnCl4遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为_______________。
(6)该微型实验的优点是________________________________________________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2=CH2+H2![]() CH3CH3
CH3CH3
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.![]() +HO-NO2
+HO-NO2![]()
 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池。
(1)选用____为负极,___为正极,电解质溶液为_____。
(2)写出电极反应式:负极_____,正极_____。
(3)画出装置图: ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛用作化妆品的香精和定香剂,也是食品香料和调味剂,还可做抗癫痫药。香草醛的分子结构如图所示。下列关于香草醛的说法中不正确的是( )
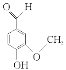
A.该化合物的分子式为C8H8O3
B.遇FeCl3溶液会显紫色
C.最多能与4 mol H2发生加成反应
D.该化合物可以发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g),△H=-QkJ/mol有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2kJ;已知Q1=3Q2。下列叙述不正确的是
2C(g),△H=-QkJ/mol有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2kJ;已知Q1=3Q2。下列叙述不正确的是
A. 甲中A的转化率为75%
B. Q1+Q2=Q
C. 达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正反应方向移动
D. 乙中的热化学方程式为2C(g)![]() A(g)+3B(g) ΔH=+Q2kJ/mol
A(g)+3B(g) ΔH=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.金刚石、石墨、C60 互为同素异形体
B.异丁烷和2-甲基丙烷互为同分异构体
C.CH4与C3H8一定互为同系物
D.35Cl 与37C1 是氯元素的两种核素,互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:A(g)+3B(g)![]() 2C(g);△H<0.有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1 kJ;在相同条件下,向乙容器中加入2mol C达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列叙述不正确的是
2C(g);△H<0.有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1 kJ;在相同条件下,向乙容器中加入2mol C达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列叙述不正确的是
A. 乙中C的转化率为75%
B. 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆
C. 在该条件下,反应 2C(g)![]() A(g)+3B(g)的平衡常数为27×1.54
A(g)+3B(g)的平衡常数为27×1.54
D. 乙中的热化学方程式为2C(g)![]() A(g)+3B(g);△H=+Q2kJ/mol
A(g)+3B(g);△H=+Q2kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com