
| A. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 | B. | 还原性(碱性溶液):I2>Fe(OH)2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 酸性(水溶液):HSCN>H2CO3>HCN |
分析 A.氧化剂的氧化性大于氧化产物的氧化性;
B.根据还原剂的还原性大于还原产物的还原性来判断,在反应物中作还原剂的是该反应中所有物质中还原性最强的;
C.根据物质分解时生成更加稳定的物质来判断;
D.根据化学反应遵循强酸制弱酸的规律来判断.
解答 解:A.在2FeCl3+2HI═2FeCl2+I2+2HCl反应中,氧化性:FeCl3>I2,在2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O中,氧化性:Co(OH)3>Cl2,又Cl2>FeCl3,
故Co(OH)3>FeCl3,则有:Co(OH)3>FeCl3>I2,故A错误;
B.在 3I2+6KOH═5KI+KIO3+3H2O反应中,I2既是氧化剂又是还原剂,其还原性介于高低价态产物之间KI>I2>KIO3;在2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI反应中,反应物中作还原剂的是该反应中所有物质中还原性最强的,即Fe(OH)2>I2;Fe(OH)2>Fe(OH)3;Fe(OH)2>KI,故还原性应为:Fe(OH)2>I2>KIO3,故B正确;
C.物质分解时生成更加稳定的物质,在反应中4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,故C正确;
D.化学反应遵循强酸制弱酸的规律,在反应2HSCN+K2CO3═2KSCN+CO2↑+H2O中,酸性HSCN>H2CO3,在反应中 KCN+CO2+H2O═HCN+KHCO3,酸性H2CO3>HCN,则酸性为HSCN>H2CO3>HCN,故D正确.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本规律及应用能力的考查,注意性质比较的方法,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸溶液,NaAlO2溶液 | B. | 浓氨水,AgNO3溶液 | ||
| C. | NaOH溶液,AlCl3溶液 | D. | Cu,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
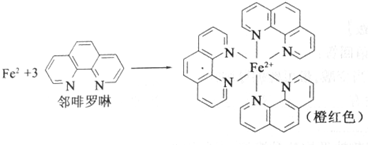
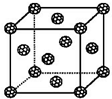
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
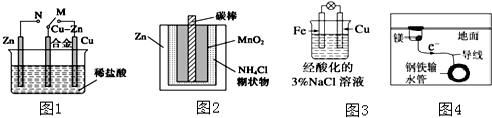
| A. | 图1中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| B. | 图2中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| C. | 图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向水玻璃中中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
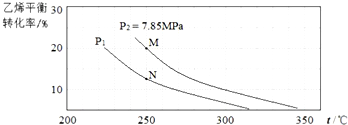
| A. | a大于0,P1小于P2 | |
| B. | M点H2O(g)的转化率为10% | |
| C. | M点化学反应速率大于N点 | |
| D. | 250℃时,用平衡分压计算的化学平衡常数 KP=$\frac{9}{16}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是具有丁达乐效应 | |
| B. | 阳离子、阴离子中均分别只含有一种元素,则由这样的阴、阳离子组成的物质一定是纯净物 | |
| C. | 白磷转化为红磷是物理变化 | |
| D. | 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶时,当加热至蒸发皿中有大量固体析出时应停止加热,利用余热蒸干剩余溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 将过氧化钠固体投入紫色石蕊溶液中,可看到石蕊溶液变蓝 | |
| D. | 用原子吸收光谱可以确定物质中含有哪些金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.60g | B. | 3.90g | C. | 6.50g | D. | 13.65g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com