
|
在含10.6 g纯碱的稀溶液中,逐滴加入含0.06 mol氯化氢的稀盐酸,并不断搅拌,充分反应后在标准状况下生成CO2的体积为 | |
| [ ] | |
A. |
2.24 L |
B. |
1.344 L |
C. |
0.672 L |
D. |
0 L |
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:阅读理解
| 温度℃ 溶解度 溶质 g/100g水 |
10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水
四种盐在不同温度下的溶解度(g/100g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
|
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市四区(杨浦、青浦、宝山、静安)高三下学期二模化学试卷(解析版) 题型:实验题
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
|
溶解度 溶质 g/100g水 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
|
NH4HCO3 |
15.8 |
21.0 |
27.0 |
|
|
|
|
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
14.4 |
16.4 |
|
|
NH4Cl |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
60.2 |
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置, a 、 b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL。此时发生的反应为:CO32- + H+ →HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含有NaHCO3 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期单元测试(6)化学试卷(新人教版) 题型:实验题
(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水
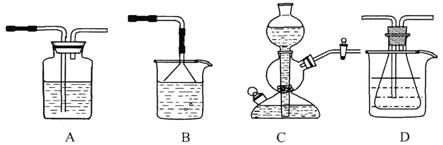
四种盐在不同温度下的溶解度(g/100g水)表
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36_3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
—① |
— |
— |
— |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
|
NH4Cl |
29.4 |
33.3 |
37.2[来源:Z|xx|k.Com] |
41.4 |
45.8[来源:Z*xx*k.Com] |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com