
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |
分析 ⑥为短周期元素,其单质为淡黄色固体,则⑥为S元素,由元素的相对位置可知:①为Li、②为F、③为Na、④为Mg、⑤为Al、⑦为Cl、⑧为K、⑨为Br.
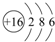
(1)⑥为S元素,原子核外有16个电子,各层电子数为2、8、6;
(2)元素①③⑧均处于IA族,主族元素最外层电子数=族序数,称为碱金属元素,同主族自上而下金属性增强;
(3)同主族自上而下非金属性减弱;⑤的氧化物是氧化铝,属于两性氧化物,③的氧化物水化物为NaOH,二者反应生成偏铝酸钠与水.
解答 解:⑥为短周期元素,其单质为淡黄色固体,则⑥为S元素,由元素的相对位置可知:①为Li、②为F、③为Na、④为Mg、⑤为Al、⑦为Cl、⑧为K、⑨为Br.
(1)⑥为S元素,原子核外有16个电子,各层电子数为2、8、6,原子结构示意图为: ,
,
故答案为:S; ;
;
(2)元素①③⑧均处于IA族,最外层电子数为1,称为碱金属元素,同主族自上而下金属性增强,故金属性③<⑧,
故答案为:1;碱金属;<;
(3)同主族自上而下非金属性减弱,②⑦⑨元素的非金属性依次减弱,⑤的氧化物是氧化铝,属于两性氧化物,③的氧化物水化物为NaOH,二者反应生成偏铝酸钠与水,反应方程式是为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:非金属性;两性;Al2O3+2NaOH=2NaAlO2+H2O.
点评 本题考查元素周期表与元素周期律应用,熟练掌握元素周期表的结构,从结构上理解同主族、元素性质递变性与相似性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
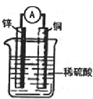 如图为某原电池示意图,请回答下列问题,
如图为某原电池示意图,请回答下列问题,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

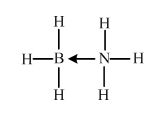 (必须标明配位犍).
(必须标明配位犍).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
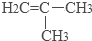 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时仰视刻度线 | |
| B. | 定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线 | |
| C. | 烧杯中的溶液未冷却至室温就将溶液移到容量瓶中 | |
| D. | 容量瓶洗涤后仍有少量残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑧ | C. | ③⑥⑨ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水要现用现制,并保存在盖有橡胶塞的棕色瓶子中,置于冷暗处 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| D. | 电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
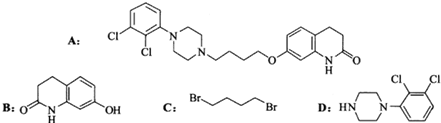
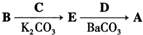
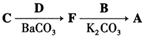
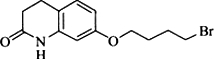 .其含氧官能团有肽键、醚键(写名称).
.其含氧官能团有肽键、醚键(写名称).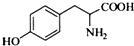 、
、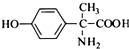 .
.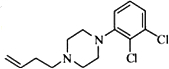 .
.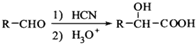 ,写出由C制备化合物
,写出由C制备化合物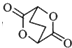 的合成路线流程图(无机试剂任选). (合成路线流程图示例如下:
的合成路线流程图(无机试剂任选). (合成路线流程图示例如下: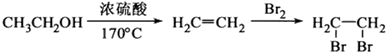 )
)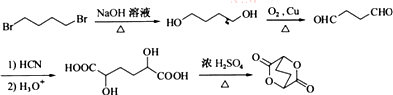 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com