
分析 (1)氯化铁溶液中滴入几滴KSCN溶液,Fe3+和SCN-发生络合反应生成Fe(SCN)3而显红色;
(2)设量少的Ba(OH)2的物质的量为1mol,根据1molBa(OH)2含1molBa2+和2molOH-来分析所需的HCO3-物质的量;
(3)MnO2与浓盐酸共热除了生成黄绿色气体即氯气外,还生成氯化锰和水;
(4)与CO2互为等电子体的含氮氧化物为N2O.
解答 解:(1)氯化铁溶液中滴入几滴KSCN溶液,Fe3+和SCN-发生络合反应生成Fe(SCN)3而显红色,离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(2)设量少的Ba(OH)2的物质的量为1mol,由于1molBa(OH)2含2molOH-,故能消耗2molHCO3-,则离子方程式为:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-,故答案为:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-;
(3)MnO2与浓盐酸共热除了生成黄绿色气体即氯气外,还生成氯化锰和水,故化学方程式为MnO2+4HCl(浓)=$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)=$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)250℃,硝酸铵分解得到与CO2互为等电子体的含氮氧化物和水,而与CO2互为等电子体的含氮氧化物为N2O,故化学方程式为:NH4NO3$\frac{\underline{\;250℃\;}}{\;}$N2O↑+2H2O↑,故答案为:NH4NO3$\frac{\underline{\;250℃\;}}{\;}$N2O↑+2H2O↑.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:实验题
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 上述反应的原子利用率可达到100% | |
| B. | 在核磁共振氢谱中对羟基扁桃酸应该有8个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应 | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铯与水反应比钠更加剧烈 | |
| B. | 原子最外层都只有一个电子 | |
| C. | 锂燃烧生成Li2O | |
| D. | 钾可以将氯化钠溶液中的钠置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
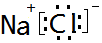 .
.| 化合物 | MgO | MgCl2 |
| 类型 | 离子化合物 | 离子化合物 |
| 熔点/℃ | 2800 | 714 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 卤族元素的最高正化合价等于其主族序数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| D. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com