
����Ŀ��CO2����Դ����������Ч����CO2�ŷţ��������̼��Դ��
��3��CO2������ϳɶ�������һ��CO2ת�����������������Ҫ�������з�Ӧ��
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H =41.2 kJ��mol1
CO(g)+H2O(g) ��H =41.2 kJ��mol1
��Ӧ��2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H =��122.5 kJ��mol1
CH3OCH3(g)+3H2O(g) ��H =��122.5 kJ��mol1
�ں�ѹ��CO2��H2����ʼ��һ���������£�CO2ƽ��ת���ʺ�ƽ��ʱCH3OCH3��ѡ�������¶ȵı仯��ͼ�����У�CH3OCH3��ѡ����=![]() ��100��
��100��
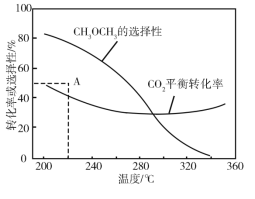
���¶ȸ���300 �棬CO2ƽ��ת�������¶����߶�������ԭ����________��
��220 ��ʱ���ڴ���������CO2��H2��Ӧһ��ʱ����CH3OCH3��ѡ����Ϊ48%��ͼ��A�㣩�����ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���ԵĴ�ʩ��________��
���𰸡���Ӧ��Ħ�H��0����Ӧ��Ħ�H��0���¶�����ʹCO2ת��ΪCO��ƽ��ת����������ʹCO2ת��ΪCH3OCH3��ƽ��ת�����½������������ȳ����½����� ����ѹǿ��ʹ�öԷ�Ӧ������Ը��ߵĴ���
��������
(3)���¶ȸ���300�棬CO2ƽ��ת�������¶����߶�������ԭ���ǣ���Ӧ�����H��0����Ӧ�����H��0�����·�Ӧ��������У���Ӧ��������У�
�ڲ��ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���Ե����������CH3OCH3��ѡ����=![]() ��100%������ƽ��������ж�����ѡ��������
��100%������ƽ��������ж�����ѡ��������
���¶ȸ���300�棬CO2ƽ��ת�������¶����߶�������ԭ���ǣ���Ӧ�����H��0����Ӧ�����H��0���¶�����ʹCO2ת��ΪCO��ƽ��ת����������ʹCO2ת��ΪCH3OCH3��ƽ��ת�����½������������ȳ����½����ȣ�
��2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)��H=-122.5kJmol-1�����CH3OCH3��ѡ����=![]() ��100%������ƽ��������ж��������ʵ�����������̼���ʵ�����С��������ѡ���������ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���ԵĴ�ʩ������ѹǿƽ��������У�ʹ�öԷ�Ӧ������Ը��ߵĴ�������������ѵ�ѡ���ԡ�
��100%������ƽ��������ж��������ʵ�����������̼���ʵ�����С��������ѡ���������ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���ԵĴ�ʩ������ѹǿƽ��������У�ʹ�öԷ�Ӧ������Ը��ߵĴ�������������ѵ�ѡ���ԡ�


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£������pH����ͬ��������Ȼ����Һ��ˮϡ��ʱ��pH�仯������ͼ��ʾ�������ж���ȷ����

A. a��c������Һ�ĵ���������ͬ
B. b����Һ��c(H+)+c(NH3��H2O)=c(OH-)
C. a��b��c������Һ��ˮ�ĵ���̶�a>b>c
D. �õ�Ũ��NaOH��Һ�͵����b��c����Һ��Ӧ������NaOH��Һ���Vb=Vc
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. CH4(g)��2O2(g)=CO2(g)��2H2O(g)����H����801.3kJ/mol ���ۣ�CH4��ȼ����Ϊ801.3kJ/mol
B. Sn(s����) ![]() Sn(s����)����H����2.1kJ/mol(����Ϊ��ĩ״)���ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
Sn(s����)����H����2.1kJ/mol(����Ϊ��ĩ״)���ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
C. ϡ��Һ���У�H��(aq)��OH��(aq)=H2O(l)����H����57.3kJ/mol���ۣ��������백ˮ��ϡ��Һ��Ϻ�������1mol H2O�����ų�57.3kJ������
D. C(s��ʯī)��O2(g)=CO2(g)����H����393.5kJ��mol��1C(s�����ʯ)��O2(g)=CO2(g)����H����395kJ��mol��1 ���ۣ���ͬ�����½��ʯ���ʱ�ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ![]()
![]()
![]()
![]() ��һ�������£����ݻ�Ϊ
��һ�������£����ݻ�Ϊ![]() ���ܱ������г���
���ܱ������г���![]() ��
��![]() �����
�����![]() ��
��![]() ��Ũ����ʱ��仯��������ͼ��ʾ��������������ȷ���ǣ� ��
��Ũ����ʱ��仯��������ͼ��ʾ��������������ȷ���ǣ� ��

A.�����¶���ʹ ����
����
B.��Ӧ�ﵽ��ѧƽ��ʱ��![]() ��ת����Ϊ75%
��ת����Ϊ75%
C.![]() ʱ����
ʱ����![]() ��ʾ������Ӧ�ķ�Ӧ���ʵ�����
��ʾ������Ӧ�ķ�Ӧ���ʵ�����![]() ��ʾ���淴Ӧ�ķ�Ӧ����
��ʾ���淴Ӧ�ķ�Ӧ����
D.�ӷ�Ӧ��ʼ����Ӧ�ﵽƽ��״̬��![]() ��ƽ����Ӧ����
��ƽ����Ӧ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ����������ȷ����
A.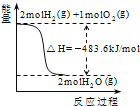 ��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ241kJ/mol
��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ241kJ/mol
B.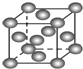 ��ʾCu�γɽ�������ʱ�Ķѻ���ʽ
��ʾCu�γɽ�������ʱ�Ķѻ���ʽ
C. װ�����ձ�a�е���ҺpH����
װ�����ձ�a�е���ҺpH����
D.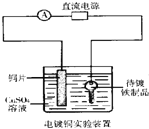 װ���д�������ƷӦ���Դ��������
װ���д�������ƷӦ���Դ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��298Kʱ��N2��H2��Ӧ�����������仯������ͼ����������������ǣ� ��

A.���¶ȡ����һ���������£�ͨ��1mol N2��3mol H2��Ӧ��ų�������Ϊ92kJ
B.a�����Ǽ������ʱ�������仯�����������ܽ��ͷ�Ӧ�Ļ�ܣ�ʹ��λ����ڻ���Ӱٷ����������
C.��������������Ч��ײ���������������N2��ת����
D.�÷�Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H= -92kJ/mol
2NH3(g) ��H= -92kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣��֪��
C(s��ʯī)��O2(g)===CO2(g) ��H1����393.5 kJ��mol��1
2H2(g)��O2(g)===2H2O(l) ��H2����571.6 kJ��mol��1
2C2H2(g)��5O2(g)===4CO2(g)��2H2O(l) ��H3����2599 kJ��mol��1
���ݸ�˹���ɣ�д��298 Kʱ��C(s��ʯī)��H2(g)����1 mol C2H2(g)�Ȼ�ѧ����ʽ��__________________________________________��
��2����1.0 L����ܱ������г���4.0 mol A(g)��4.0 mol B(g)����һ���¶��½��з�Ӧ��A(g)+B(g)C(g) ��H����ò�ͬʱ�̸����������ʵ����ʵ������±�:
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
�ش��������⣺
�������¶ȵ����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣ����С������H___(����>����<������=��)0����Ӧ����ʼ��30min��A��ƽ����Ӧ������_______�����¶��£�������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ____��
������ѡ������˵���÷�Ӧ��һ���¶Ⱥͺ��������´ﵽƽ��״̬����________��
A. ��Ӧ���ʣ�vA(��) =vC(��) B. A��������C���������
C. B��ת���ʲ��ٸı� D. �ܶȲ��ٸı�
��3������ӦC(g)A(g)+B(g)����ʱ�����ϡ�ͼ�X����(�����뷴Ӧ)����C��ƽ��ת������ѹǿ��X�����ʵ����Ĺ�ϵ��ͼ��ʾ��
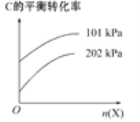
��������������ʱ������X�����ʵ�����C��ƽ��ת���ʽ�________(��������������С������������)����ԭ����______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ں����ܱ������У��ܱ�ʾ��ӦX(g)+2Y(g)![]() 2Z(g)һ���ﵽ��ѧƽ��״̬����
2Z(g)һ���ﵽ��ѧƽ��״̬����
A.�����е�ѹǿ���ٷ����仯
B.X��Y��Z�����ʵ���֮��Ϊ1:2:2
C.X��Y��Z������֮��1:2:2
D.��λʱ��������n mol Z��ͬʱ����n mol Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϵ�ⷨ�����������Է�ˮ���õ�����Ni��ԭ����ͼ��ʾ��
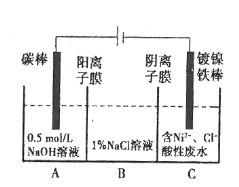
��֪����Ni2+����������Һ�з���ˮ��������ԣ�Ni2+(��Ũ��)��H+��Ni2+(��Ũ��)������˵������ȷ����
A.̼���Ϸ����ĵ缫��Ӧ��4OH����4e-=O2��+2H2O
B.Ϊ�����Ni�IJ��ʣ�����������Ҫ���Ʒ�ˮpH
C.�������У�B��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ���
D.����ͼ��������Ĥȥ������A��B���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com