
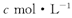 的氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将所得沉淀灼烧至质量不再改变为止,得到固体p g0则下列关系不正确的是
的氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将所得沉淀灼烧至质量不再改变为止,得到固体p g0则下列关系不正确的是A.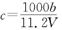 | B.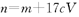 | C. | D. |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源:不详 题型:单选题
| A.6g | B.8g | C.10g | D.12g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
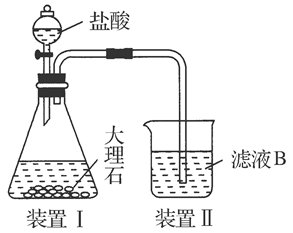
 验完成下列问题:
验完成下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
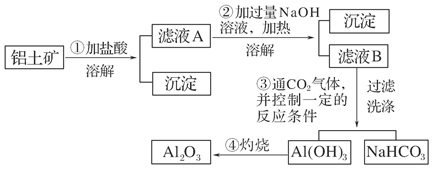

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝片与盐酸反应生成氢气 | B.氢氧化铝溶于强碱溶液 |
| C.氢氧化铝溶于强酸溶液 | D.铝热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com