
| A. | 烧碱 | B. | 纯碱 | C. | 硫酸 | D. | 液溴 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化.
解答 解:A.工业生产烧碱涉及的反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故A不选;
B.氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;
C.硫酸工业中存在S~SO2~SO3的转化,化合价发生变化,为氧化还原反应,故C不选;
D.工业生产液溴利用氯气将溴离子氧化成溴单质,化合价发生变化,为氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应、化学工业原理,明确各工业生成原理是解本题关键,难度不大.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:填空题
 .
.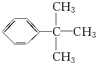 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成可降解塑料聚碳酸酯,实现“碳”的循环利用 | |
| B. | 由地沟油加工合成的“生物柴油”与柴油成分相同 | |
| C. | 高温消毒就是用加热的方法使蛋白质变性 | |
| D. | 海水提镁、炼铁、制造玻璃等工业都用到石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯硫酸的摩尔质量为98 | |
| B. | 上述100mL稀硫酸中含溶质14g | |
| C. | 上述稀释过程所需要的蒸馏水为90mL | |
| D. | 质量分数为50%的硫酸物质的量浓度为7.14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
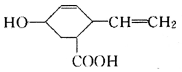
| A. | 分子式为C9H12O3,可以燃烧 | |
| B. | 能发生取代反应和聚合反应 | |
| C. | 能使酸性高锰酸钾溶液和溴的CCl4溶液褪色,褪色原理相同 | |
| D. | 分子中所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
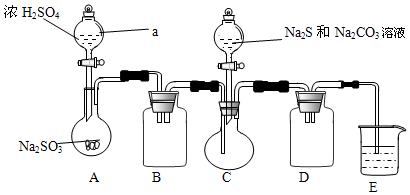
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
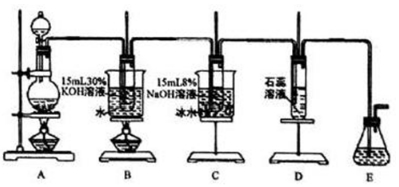
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ------------- |
| 步骤2: 向A试管中加入1-2mL 0.0lmol•L-1 KMnO4溶液,振荡试管 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
| 步骤3: 向B试管中滴加1-2滴淀粉-KI溶液 | (1)若溶液变蓝,则假设成立 (2)若溶液不变蓝,综合步骤中的(2),则假设2成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com