
判断正误,正确的划“√”,错误的划“×”
(1)检验NH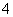 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 ( )
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 ( )
(2013·福建理综,10D)
(2)液氨汽化时要吸收大量的热,可用作制冷剂 ( )
(2013·江苏,4A)
(3)可用浓盐酸检验氨气,反应为NH3+HCl===NH4Cl ( )
(2013·北京理综,8A改编)
(4)实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应 ( )
(2012·广东理综,10D)
(5)过量的铜与浓硝酸反应有一氧化氮生成 ( )
(2012·重庆理综,7C)
(6)将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
( )
(2012·山东理综,12D)
(7)向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,是因为HNO3分解生成了NO2  ( )
( )
(2011·四川理综,11A)
(8)用浓HNO3与Cu反应制备NO2 ( )
(2012·广东理综,9C)
科目:高中化学 来源: 题型:
1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
已知:①相关物质的物理常数如下。
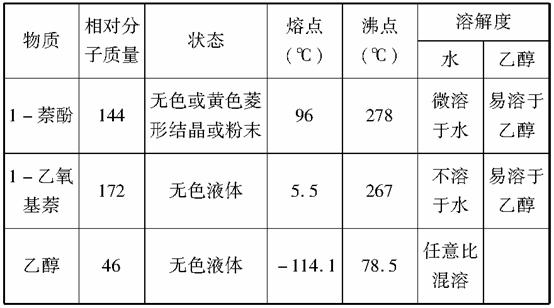
②1-萘酚的性质与苯酚相似,有难闻的苯酚气味,苯酚在空气中易被氧化为粉红色。
请回答以下问题:
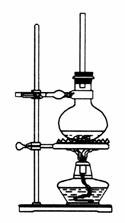
(1)将72 g 1-萘酚溶于100 mL无水乙醇中,加入5 mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是___________________________________________。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________________(填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是________________。
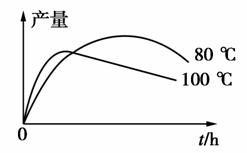
(4)提纯的产品经测定为43 g,本实验中1-乙氧基萘的产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某可逆反应X(g)+Y(g)Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
| T/℃ | 700 | 800 | 850 | 1000 |
| K | 0.01 | 0.05 | 0.10 | 0.40 |
(1)上述反应的平衡常数表达式K=________,ΔH________0(填“>”或“<”)。加入催化剂,该反应的ΔH将________(填“增大”、“减小”或“不变”)。
(2)若上述反应在绝热恒容的密闭容器内进行,则能说明该反应达到化学平衡状态的依据有________。
A.混合气体的密度保持不变
B.v正(X)=v正(Z)
C.容器内温度恒定
D.W的质量分数不变
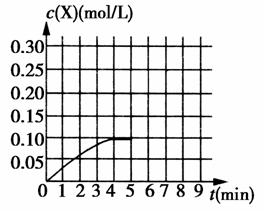
(3)在850 ℃、体积为1 L的密闭容器内,加入0.2 mol Z和0.3 mol W发生上述反应。X的c(X)-t曲线如图所示。
①0~4 min内W的平均速率为________mol·L-1·min-1。
②在5 min末将容器体积缩小至0.5 L,若在8 min末达到新平衡(此时X的浓度约为0.26 mol/L),请在图中画出5 min~9 min的X浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并
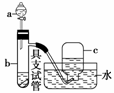 观察还原产物的实验装置。
观察还原产物的实验装置。
Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:______________________________________
________________________________________________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象
________________________________________________________________________
________________________________________________________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是________________________________________________________________________
________________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是______________________________
(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是________________________________________________________________________
________________________________________________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:____________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:____________________________________________________________
________________________________________________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_______________________________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的铁和足量的稀硝酸或浓硝酸完全反应,在相同条件下,用排水集气法收集产生的气体。下列叙述一定正确的是 ( )
①硝酸浓度越大,消耗的硝酸越少
②硝酸浓度不同,生成的Fe(NO3)3的物质的量相同
③硝酸浓度越大,产生的气体越少
④用排水集气法收集到的气体在相同状况下体积相同
A.只有② B.②④ C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在氧气中灼烧硫和铁组成的化合物0.44 g,使其中的硫全部转化为二氧化硫,把这些二氧化硫全部氧化成硫酸。这些硫酸可以用20 mL 0.5 mol/L氢氧化钠完全中和。则原化合物中硫的质量分数约为( )
A.18% B.46%
C.53% D.36%
查看答案和解析>>
科目:高中化学 来源: 题型:
计算或判断下列电解质溶液中的粒子数目
(1)含0.4 mol Al2(SO4)3的溶液中,含________mol SO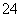 ,Al3+的物质的量________
,Al3+的物质的量________
0.8 mol(填“>”、“<”或“=”)。
(2)1 L 0.1 mol·L-1的CH3COOH溶液中,n(CH3COOH)________ 0.1 mol,
n(CH3COO-)________ 0.1 mol,n(H2O)________ 0.1 mol(填“大于”、“小于”或“等 于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com