
【题目】在稀氨水中存在下述电离平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
c(OH-)的变化 | |||
平衡移动方向 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是
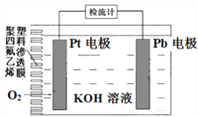
A. Pt电极上发生还原反应
B. 随着使用,电解液的pH逐渐减小
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:

已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为CH3CH2OH![]() CH2=CH2↑+H2O,回答下列问题:
CH2=CH2↑+H2O,回答下列问题:

(1)图1中仪器①、②的名称分别为______、______。
(2)收集乙烯气体最好的方法是______。
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_____(填反应类型),若将反应后无色液体中的反应产物分离出来,则宜采用的方法是_____。
II.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请回答下列问题:
(4)甲同学的实验中有关的化学方程式为______。
(5)甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是_____(填字母)。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质就是乙烯
(6)乙同学推测此乙烯中必定含有的一种杂质气体是______,它与溴水反应的化学方程式是___。在验证过程中必须全部除去,除去该杂质的试剂可选用______。
(7)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取方法有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出的相应结论正确的是( )
实验 | 现象 | 结论 |
A.某溶液中滴加 | 产生蓝色沉淀 | 原溶液中有 |
B.①某溶液中加入 ②再加足量盐酸 | ①产生白色沉淀 ②仍有白色沉淀 | 原溶液中有 |
C.向含有 | 生成黑色沉淀 |
|
D.向 | 溶液变浑浊 | 酸性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属的冶炼根据金属的活动性不同,可以采用不同的冶炼方法,以下不是金属冶炼方法的是
A.2HgO![]() 2Hg+O2↑
2Hg+O2↑
B.2NaCl(熔融) ![]() 2Na+Cl2↑
2Na+Cl2↑
C.SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图

①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产纯碱的工艺流程示意图如下:
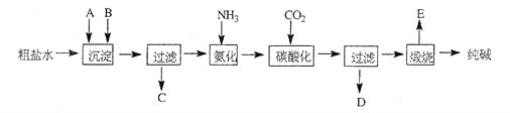
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A于石灰窑厂),写出A、B的化学式;A_______B_______
(2)实验室提纯粗盐的实验操作依次为:_______
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_______。碳酸化时没有析出碳酸钠晶体,其原因是_______。
(4)碳酸化后过滤,滤液D最主要的成分是_______ (填写化学式),检验这一成分的阴离子的具体方法是_______:。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:_______,滤液D加石灰水前先要加热,原因是_______。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:_______ (注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com