
【题目】为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10molL-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
【答案】酸高锰酸钾具有强氧化性锥形瓶内溶液颜色变化锥形瓶内溶液颜色恰好由无色变为紫红色,且半分钟内颜色不恢复0.21 molL-1偏小无影响偏小
【解析】
(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;
(2)滴定时,左手控制滴定管活塞,右手摇动锥形瓶,眼睛注视溶液颜色的变化;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,锥形瓶内溶液颜色恰好由无色变为紫红色,且半分钟内颜色不恢复;
(3)2KMnO4~~~~~~5H2C2O4
2 5
0.10×21.00×10-3mol 0.025×cmol
![]() ,解得:c=0.21 molL-1;
,解得:c=0.21 molL-1;
(4)A、滴定前仰视,读数偏大,滴定后俯视,读数偏小,所得差值偏小,所以测定结果偏小;B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水,对测定结果无影响;C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分,则待测液的体积减少,消耗标准液的体积减少,测定结果偏小。


科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是
A. 对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B. 热化学方程式中的化学计量数不能用分数表示
C. Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
A. 溶液中导电粒子的数目增加,导电性增强
B. 醋酸的电离程度增大,pH增大
C. 再加入10mLpH=11NaOH溶液,混合液pH>7
D. 溶液中c(CH3COO—)/c(CH3COOH)c(OH—)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展煤化工是推动山西能源革命的重要力量,煤的干馏是煤化工的一种重要途径。
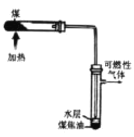
(1)煤的干馏属于_____________变化(填“物理”或“化学”)。
(2)煤干馏后得到的固体物质主要是___________,得到的可燃性气体中的一种成分是___________。
(3)煤焦油中含有苯, 用苯制硝基苯的化学方程式是_________,该反应类型属于_________。
(4)煤焦油经过分馏可以得到萘(![]() ),其分子式是_____________.
),其分子式是_____________.
(5) 为证明上图实验中得到的水层含有氨,可进行的实验操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL 18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
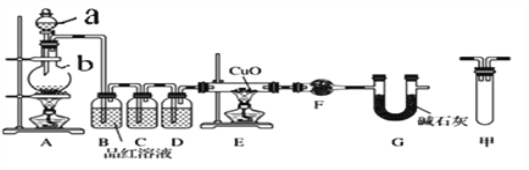
(1)填写仪器名称:a_______________。
(2)写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
(3)装置D中加入的试剂是__________。
(4)U型管G的作用为______________。
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
(6)证明反应生成SO2和H2的实验现象是_________________。
(7)若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com