
【题目】下列说法正确的是
(1)增加水的量或温度,都可以加快镁跟水的反应速率。
(2)增加硫酸的浓度,一定可以加快铁与硫酸反应的速率
(3)对于反应CaCO3(s)![]() CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对反应3H2(g) + N2(g)![]() 2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g)![]() 2NH3(g),使用催化剂,正逆反应速率同等程度加快。
2NH3(g),使用催化剂,正逆反应速率同等程度加快。
A. (1) (2)B. (1) (2) (3)C. (1) (2) (3) (4)D. (5)
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFe2(PO4)3作为锂离子电池的负极材料时有良好的放电平台,通过提高材料的电导率可以有效的改善材料的性能。
(1)配平下列反应的化学方程式。___
___LiFe2(PO4)3+1Fe2O3+___CO→____CO2+___LiFePO4
(2)CO2的电子式为____,P原子的核外电子有___种不同能量的电子。
研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。
2H2(g)+2CO(g)。
(3)该反应的平衡常数K=____。在2L密闭容器中,通入CO2和CH4的混合气体,30min后,CH4的质量减少了4.8g,则v(CH4)=___。
(4)根据如图可得出n(CO2)消耗___n(CH4) 消耗(填“>”、“<”和“=”),原因是___。
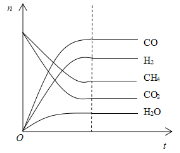
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
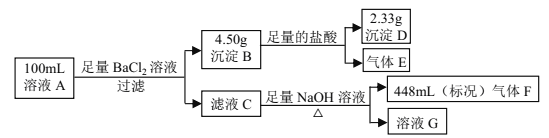
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5molFe在O2中燃烧失去的电子数为1.5NA
B.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
C.1molC2H4中所含共用电子对数为6NA
D.1L0.5mol·L-1KHCO3溶液中,阴阳离子总数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1 molL-1 。
阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有 _____________,阴离子有__________。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___________________________。
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液中溶质的物质的量浓度为___________ molL-1 (精确到小数点后第三位)。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:Cl2+2HBr=Br2+2HCl。当有0.2molHCl(g)生成时放出8.1kJ的热量。
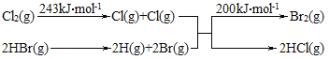
其能量变化示意图如图:请回答:
(1)该反应的热化学方程式是_____。
(2)由上述数据判断断开1molH-Cl键与断开1molH-Br键所需能量相差约为_____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2+3H2![]() 2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
A. 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等
B. 增加c(N2)瞬间,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
C. 降温,v(正)和v(逆)都减少,且v(正)减少倍数小于v(逆)减少倍数
D. 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com