
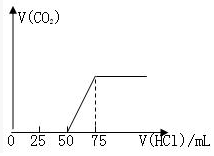
 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?
有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少? 分析 当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗HCl为75mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑计算二氧化碳体积.
解答 解:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗HCl为75mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,
中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,浓度之比是1:1,生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.025L×0.1mol/L×22.4L/mol=0.056L=56mL=0.056L,
答:向NaOH溶液中通入CO2气体后,所得溶液中的溶质是NaOH、Na2CO3;其物质的量之比1:1;气体体积为0.056L.
点评 本题考查混合物计算,根据消耗盐酸的体积判断图象中各阶段发生的反应是解答的关键,侧重考查学生分析思维能力,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 我国目前最主要的能源是煤炭 | |
| B. | 人体运动所消耗的能量与化学反应无关 | |
| C. | 人类目前所直接利用的能量大部分是由化学反应所产生的 | |
| D. | 煤、石油、天然气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 实验室金属钠着火,立即用水浇灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁表面发生析氢腐蚀时,钢铁表面水膜的pH增大 | |
| B. | 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少 | |
| C. | 在镀件上电镀锌,可以用锌作阳极,用硫酸锌溶液作电解质溶液 | |
| D. | 原电池的负极和电解池的阴极上都是发生失电子过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个甲基,可能生成4种一氯代物 | B. | 3个甲基,可能生成3种一氯代物 | ||
| C. | 3个甲基,可能生成5种一氯代物 | D. | 4个甲基,可能生成4种一氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}、高温}{→}$SiCl4$\stackrel{H_{2}、高温}{→}$Si | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2 $\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
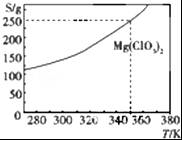 Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% | |
| D. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com