
| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
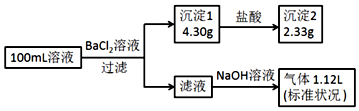
分析 加入氯化钡溶液,生成沉淀,一定含有碳酸根或是硫酸根中的至少一种,则该沉淀为BaSO4、BaCO3中的至少一种,沉淀部分溶解于盐酸,所以一定是BaSO4、BaCO3的混合物,一定存在CO32-、SO42-,硫酸钡沉淀是2.33g,物质的量是$\frac{2.33g}{233g/mol}$=0.01mol,碳酸根离子的物质的量是$\frac{4.3g-2.33g}{197g/mol}$mol=0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是$\frac{1.12L}{22.4L/mol}$=0.05mol,钠离子和氯离子需要根据电荷守恒进行判断,以此解答该题.
解答 解:A.由以上分析可知原溶液一定存在CO32-和SO42-、Cl-,一定不存在Fe3+,故A正确;
B.原溶液一定存在Cl-,可能存在Na+,故B错误;
C.阳离子为铵根离子,所带正电荷的物质的量为0.05mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,所以一定存在氯离子,钠离子不能确定,n(Cl-)≥0.01mol,所以c(Cl-)≥0.1mol•L-1,故C错误;
D.铵根离子的物质的量是$\frac{1.12L}{22.4L/mol}$=0.05mol,而体积为0.1L,则原溶液中c(NH4+)=0.5mol•L-1,故D错误.
故选A.
点评 本题考查无机物的推断,侧重常见阴阳离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 电解硫酸时,阴极产生 1molH2时,阳极一定产生 0.5molO2 | |
| B. | 盛有 SO2 的密闭容器中含有 NA 个氧原子,则 SO2 的物质的量为 0.5mol | |
| C. | 电解 1mol 熔融的 Al2O3,能产生 33.6L 氧气、54.0g 金属铝 | |
| D. | 工业用电解法进行粗铜精炼时,每转移 1mol 电子,阳极上就溶解 0.5NA 个铜原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 所有的糖类、油脂和蛋白质都能发生水解反应 | |
| D. | 符合分子式C5H12的物质有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不可能含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 非极性键只存在于双原子单质分子里 | |
| D. | 金属元素和非金属元素形成的化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过酸性高锰酸钾溶液 | B. | 通过澄清石灰水 | ||
| C. | 通过饱和Na2CO3溶液 | D. | 通过氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 22.4 mol/L | C. | 0.045 mol/L | D. | 0.03 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜的水溶液中,铜离子实际上主要以四水合铜离子的形式存在 | |
| B. | 氯化银沉淀能溶于氨水,说明有的配合物(或配离子)很稳定 | |
| C. | 金属离子都能作为中心离子,含有孤对电子的分子(或离子)都可作配体 | |
| D. | 硫氰合铁(III)离子呈血红色,由此可用KSCN溶液检验Fe3+离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com