
| A. | 被氧化的HCl为0.4mol | B. | 转移的电子数为0.2NA | ||
| C. | 该反应中HCl只作还原剂 | D. | Cl2为还原产物 |
分析 由方程式可知,当有1molMnO2参加反应,有4molHCl参加反应,但生成1molCl2,说明有2molHCl被氧化,n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,结合方程式计算.
解答 解:n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑被氧化HCl
1 4 2
0.1mol 0.4mol 0.2mol
A.被氧化的HCl为0.2mol,故A错误;
B.氧化0.2molHCl,Cl元素化合价由-1价升高到0价,转移的电子数为0.2NA,故B正确;
C.反应中只有部分Cl元素化合价变化,HCl起到还原剂和酸性的作用,故C错误;
D.Cl元素化合价升高,被氧化,则Cl2为氧化产物,故D错误.
故选B.
点评 本题考查氧化还原反应的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握元素的化合价的变化,为解答该题的关键,答题注意注意结合方程式计算,难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | 用过滤法除去Fe(OH)3胶体中的FeCl3 | |
| B. | 用25mL碱式滴定管量取20.10mLNa2CO3溶液 | |
| C. | 将SO2通入酸性KMnO4溶液中,可证明SO2具有漂白性 | |
| D. | 欲鉴别AlC13溶液和AgNO3溶液,向2种待测液中分别滴加足量氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个N≡N键断裂的同时,有2个N-H键断裂 | |
| B. | 3V正(N2)=V逆(H2) | |
| C. | 容器内混合气体的密度不再变化 | |
| D. | 容器内N2、H2、NH3的浓度比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
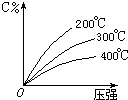 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 化学方程式中n>e+f | |
| C. | 达平衡后,若升温,平衡右移 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “超纯水”、“超纯蒸馏水”绝对卫生,对人体有益 | |
| B. | 含碘食盐可防治甲状腺肿大,但也不能滥补,造成体内碘含量过高 | |
| C. | 本饮料由纯天然物质配置而成,绝对不含化学物质,对人体无害 | |
| D. | 含氟牙膏可适合任何人群预防龋齿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子组 | 保留在溶液中的离子 |
| 1Zn2+和Al3+ | |
| 2Zn2+和Mg2+ | |
| 3Zn2+和Ba2+ | |
| 4Fe3+和Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
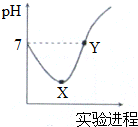 常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )| A. | X、Y两点所示溶液中含有微粒的种类前者多 | |
| B. | X、Y两点所示溶液中水的电离程度前者大 | |
| C. | Y点所示溶液中存在c(Na+)=c(HClO)+2c(ClO-) | |
| D. | X点所示溶液中发生反应的离子方程式为Cl2+H2O═2 H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都增大,平衡不移动 | |
| B. | 正、逆反应速率都不变,平衡不移动 | |
| C. | 正、逆反应速率都增大,平衡向左移动 | |
| D. | 正、逆反应速率都增大,平衡向右移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com