
【题目】碱金属元素按原子序数增大,依次为:锂(![]() )、钠(
)、钠(![]() )、钾(
)、钾(![]() )、铷(
)、铷(![]() )、铯(
)、铯(![]() )、钫(
)、钫(![]() ,放射性元素)。请回答:
,放射性元素)。请回答:
(1) 钠钾合金许多特殊反应中有着非常重要的应用。取![]() 钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出
钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出![]() 纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
(2)将一定量的铝和过氧化钠混合物投入一盛有![]() 蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少
蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少![]() ,再向所得溶液中滴加
,再向所得溶液中滴加![]() 盐酸直至产生的沉淀刚好溶解,消耗盐酸
盐酸直至产生的沉淀刚好溶解,消耗盐酸![]() 。求原混合物中
。求原混合物中![]() 和
和![]() 各多少克?____、____
各多少克?____、____
(3)一定条件下,![]() 铷与氧气和臭氧的混合气体
铷与氧气和臭氧的混合气体![]() (已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物
(已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物![]() 和
和![]() 的固体混合物。
的固体混合物。![]() 和
和![]() 中,阴阳离子个数比均为
中,阴阳离子个数比均为![]() 且均在两种微粒间作用力。已知
且均在两种微粒间作用力。已知![]() 的含氧量为0.3596。推断化合物
的含氧量为0.3596。推断化合物![]() 、
、![]() 的化学式分别为:____________、____________。
的化学式分别为:____________、____________。
【答案】![]()
![]()
![]()
![]()
![]()
【解析】
(1)发生反应有:CCl4+4Na ![]() C(金刚石)+4NaCl、CCl4+4K
C(金刚石)+4NaCl、CCl4+4K ![]() C(金刚石)+4KCl,设出金属钠和钾的物质的量,然后分别根据合金总质量、生成金刚石的量列式计算;
C(金刚石)+4KCl,设出金属钠和钾的物质的量,然后分别根据合金总质量、生成金刚石的量列式计算;
(2)设生成氧气物质的量为x,生成氢气物质的量为y,结合化学方程式定量计算得到原混和物中Al和Na2O2的物质的量;
(3)根据含氧量计算出A的化学式,再结合铷与氧原子个数比,结合B中阴阳离子个数比均为![]() ,且均在两种微粒间作用力确定B的化学式。
,且均在两种微粒间作用力确定B的化学式。
(1)钠、钾与四氯化碳反应的方程式为:CCl4+4Na ![]() C(金刚石)+4NaCl、CCl4+4K
C(金刚石)+4NaCl、CCl4+4K ![]() C(金刚石)+4KCl,设合金中钠、钾的物质的量分别为x、y,则根据总质量可得:①23x+39y=59.80g,根据反应方程式可知,生成金刚石的总量为:②12×(x+y)×
C(金刚石)+4KCl,设合金中钠、钾的物质的量分别为x、y,则根据总质量可得:①23x+39y=59.80g,根据反应方程式可知,生成金刚石的总量为:②12×(x+y)×![]() =5.40g,联立①②解得:x=0.65、y=1.15,则合金中钠、钾的质量比为:(23g/mol×0.65mol)∶(39g/mol×1.15mol)=1∶3,故答案为:1∶3;
=5.40g,联立①②解得:x=0.65、y=1.15,则合金中钠、钾的质量比为:(23g/mol×0.65mol)∶(39g/mol×1.15mol)=1∶3,故答案为:1∶3;
(2)根据题意,所得溶液的质量比反应前上述三种物质总质量之和减少3.5g,是反应放出的氢气和氧气。设生成氧气物质的量为x,生成氢气物质的量为y,则有①x×32+y×2=3.5g
2Na2O2+2H2O=4NaOH+O2↑,
2 4 1
2x 4x x
2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
2 2 2 3
![]() y
y ![]() y
y![]() y y
y y
再向所得溶液中滴加3.5mol/L盐酸直至产生的沉淀刚好溶解,
NaAlO2+4HCl=AlCl3+2H2O+NaCl
1 1
![]() y
y ![]() y
y
最终溶液中的溶质为氯化钠和氯化铝,根据钠、铝和氯元素守恒有②4x+![]() y×3=0.2L×3.5mol/L,联立①和②解得:x=0.1mol,y=0.15mol,原混和物中,Al物质的量=0.15mol×
y×3=0.2L×3.5mol/L,联立①和②解得:x=0.1mol,y=0.15mol,原混和物中,Al物质的量=0.15mol×![]() =0.1mol,质量为2.7g,Na2O2物质的量=2×0.1mol=0.2mol,质量为0.2mol×78g/mol=15.6g,故答案为:2.7g;15.6g;
=0.1mol,质量为2.7g,Na2O2物质的量=2×0.1mol=0.2mol,质量为0.2mol×78g/mol=15.6g,故答案为:2.7g;15.6g;
(3)A中铷和氧的物质的量之比为:![]() ∶
∶![]() =1∶3,故A的化学式为:RbO3;标准状况下,22.4L氧气和臭氧的混合气体的物质的量为1mol,混合气体对相同状况下氢气的相对密度为20.8,则混合气体的平均摩尔质量为41.6g/mol,因此含有氧原子的物质的量为
=1∶3,故A的化学式为:RbO3;标准状况下,22.4L氧气和臭氧的混合气体的物质的量为1mol,混合气体对相同状况下氢气的相对密度为20.8,则混合气体的平均摩尔质量为41.6g/mol,因此含有氧原子的物质的量为![]() =2.6mol,85.5g铷的物质的量=
=2.6mol,85.5g铷的物质的量=![]() =1mol,设B的化学式为RbOy,因为B中阴阳离子个数比均为1∶1,故B中若含有1个B+离子,则含有一个阴离子,且均在两种微粒间作用力,因此阴离子中至少2个氧原子,又因为A为RbO3,则B中含有氧原子数少于2.6,只能为2,因此B的化学式为RbO2,故答案为:RbO3;RbO2。
=1mol,设B的化学式为RbOy,因为B中阴阳离子个数比均为1∶1,故B中若含有1个B+离子,则含有一个阴离子,且均在两种微粒间作用力,因此阴离子中至少2个氧原子,又因为A为RbO3,则B中含有氧原子数少于2.6,只能为2,因此B的化学式为RbO2,故答案为:RbO3;RbO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Deacon法制备Cl2的反应为4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。如图为恒容容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系。下列说法正确的是( )
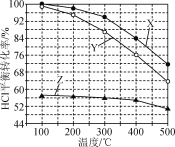
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH>0
B.Z曲线对应进料浓度比c(HCl)∶c(O2)=7∶1
C.400 ℃,进料浓度比c(HCl)∶c(O2)=4∶1时,O2平衡转化率为19%
D.400 ℃,进料浓度比c(HCl)∶c(O2)=1∶1时,c起始(HCl)=c0 mol·L-1,平衡常数K=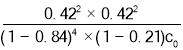
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。钴酸锂电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及镀镍金属钢壳等,处理该废旧电池的一种工艺如下图所示:
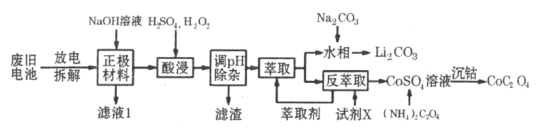
回答下列问题:
(1)Li原子结构示意图为_______,LiCoO2中Co的化合价是__________。
(2)用NaOH溶液处理正极材料的离子方程式为____________________________。
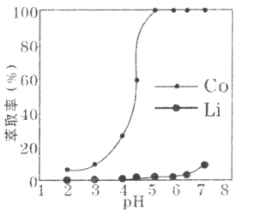
(3)“酸浸”过程中LiCoO2发生反应的离子方程式为___________________________。保持其他因素不变的情况下,“酸浸”时Co、Li元素的浸出率随温度的变化如右图所示,当温度高于80℃时Co元素浸出率下降的原因有:
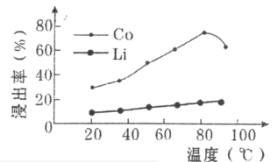
①Co2+水解加剧;②________________________________。
(4)调节pH的目的是使Ni2+和_______________(填离子符号)全部沉淀。
(5)“萃取”环节,钴、锂萃取率与平衡时溶液pH的关系如下图所示,为了实现钴、锂分离效果较好,pH一般选择______________(填整数)左右。
(6)“萃取”和“反萃取”可简单表示为![]() ,则反萃取过程中加入的试剂X是___________________________(填名称)。
,则反萃取过程中加入的试剂X是___________________________(填名称)。
(7)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g和一种无毒无污染的气体,则该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现一定量的铁铝合金与很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液![]() 中,逐滴加入
中,逐滴加入![]() 的氢氧化钠溶液,所加氢氧化钠溶液的体积(
的氢氧化钠溶液,所加氢氧化钠溶液的体积(![]() )与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
)与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
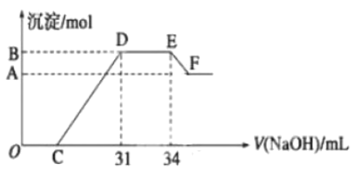
A.溶液![]() 中所含的阳离子有:
中所含的阳离子有:![]() 、
、![]() 、
、![]() 、
、![]()
B.在![]() 段,发生反应的离子方程式为
段,发生反应的离子方程式为![]()
C.无法求出![]() 点对应的沉淀的物质的量
点对应的沉淀的物质的量
D.![]() 点对应的氢氧化钠溶液的体积为
点对应的氢氧化钠溶液的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
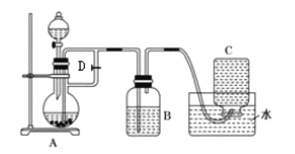
【题目】下图所示装置可用来制取和观察![]() 在空气中被氧化时的颜色变化,实验时必须使用铁屑、稀硫酸、
在空气中被氧化时的颜色变化,实验时必须使用铁屑、稀硫酸、![]() 溶液,其他试剂任选。
溶液,其他试剂任选。
完成下列填空:
(1)![]() 中盛有一定量的
中盛有一定量的![]() 溶液,烧瓶
溶液,烧瓶![]() 中应预先加入的试剂是______。
中应预先加入的试剂是______。![]() 中发生反应的离子方程式为____________。
中发生反应的离子方程式为____________。
(2)实验开始前应先将活塞![]() ______(填“打开”或“关闭”),其目的是______。
______(填“打开”或“关闭”),其目的是______。
(3) 简述生成![]() 的操作过程____________。
的操作过程____________。
(4)若拔掉装置![]() 中的橡胶塞,使空气进入,写出有关反应的化学方程式:____________。
中的橡胶塞,使空气进入,写出有关反应的化学方程式:____________。
请描述实验现象:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①氯化钡、②金刚石、③氯化铵、④硫酸钠、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,以分子间作用力结合的是________。
(3)①的电子式是____________,⑥的电子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
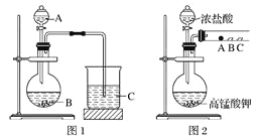
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行如下实验,能达到实验目的的是

A. 瓶中盛满水,从B口进气,用排水法收集HCl气体
B. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
C. 从B口进气,用排空气法收集CO2
D. 瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锥形瓶中装有部分变质的漂粉精粉末和红色纸花,向其中注射浓盐酸,观察到纸花褪色,并有黄绿色气体生成,该实验可以得到的结论是( )
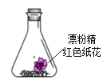
A.说明![]() 具有漂白性B.实验中只发生了氧化还原反应
具有漂白性B.实验中只发生了氧化还原反应
C.浓盐酸被氧化D.反应中生成的气体只有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com