
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 浓硫酸沾在皮肤上时应用大量水冲洗,再涂上3%~5%的NaOH溶液 | |
| C. | 实验室进行蒸馏操作时若忘加了沸石,应停止反应冷却至室温后再加入 | |
| D. | 配制硫酸溶液时,可先在量筒中加一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
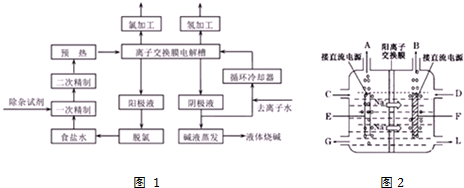
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
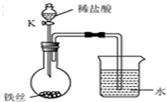 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇所含的分子数为NA | |
| B. | 1mol/LCaCl2溶液中含有的氯离子数目为2NA | |
| C. | 1 mol金属钠在足量乙醇完全反应转移的电子数为2NA | |
| D. | 1.6g 甲烷中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1mol KClO3参加反应,转移的电子为1mol | |
| D. | H2C2O4的氧化性强于ClO2的氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com