
| A. | 1mol•L-1 的AlCl3溶液中,含Al3+数小于NA | |
| B. | 标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为NA | |
| C. | 1mol NaBH4中含的离子的数目为6NA | |
| D. | 30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
分析 A、溶液体积不明确;
B、HCl溶于水后,全部电离为氢离子和氯离子;
C、NaBH4由1个钠离子和1个BH4-构成;
D、甲醛和醋酸的最简式均为CH2O.
解答 解:A、溶液体积不明确,故溶液中的铝离子的个数无法计算,故A错误;
B、HCl溶于水后,全部电离为氢离子和氯离子,故溶液中无HCl分子,故B错误;
C、NaBH4由1个钠离子和1个BH4-构成,故1mol中含2NA个离子,故C错误;
D、甲醛和醋酸的最简式均为CH2O,故30g混合物中含有的CH2O的物质的量为1mol,则含有NA个碳原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
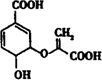 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )| A. | 分子中含有3种含氧官能团 | |
| B. | 1 mol分枝酸最多可与2mol NaOH发生中和反应 | |
| C. | 在一定条件下可与乙醇、乙酸反应,但反应类型不相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但褪色原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M气体是密度最小的气体 | |
| B. | X的氧化物与Y的最高价氧化物对应水化物能发生化学反应 | |
| C. | Z在周期表的第五周期,ⅤA族 | |
| D. | X的离子比Y离子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到2电子或8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
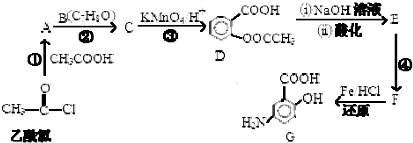
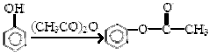 ,
, (具有还原性,极易被氧化)
(具有还原性,极易被氧化) .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式)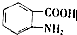 的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.4g体积比为3:1的CO2和N2O组成的混合气体中所含原子总数为0.3NA | |
| B. | CH4与P4的分子结构均为正四面体形,在1molCH4或P4分子中含有共价键数皆为4NA | |
| C. | 含有NA个阴离子的Na2O溶于水形成1L的溶液中,溶质的物的质量浓度为1mol•L-1 | |
| D. | 标准状况下,5.6L18O2参加反应一定转移NA个e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com