
【题目】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,结构如图,下列说法正确的是( )
![]()
A.分子式为C3H6O3
B.分子中既有极性键也有非极性键
C.分子中σ键与π键个数之比为3:1
D.分子中碳原子的杂化方式全部为sp2杂化
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种植物合成叶绿素的催化剂,也可用于制备多种含锰物质。
回答下列问题:
⑴工业上可用惰性电极电解MnSO4溶液的方法制备MnO2,其阳极的电极反应式为________。
⑵我国普遍采用两矿加酸法制备MnSO4。两矿指软锰矿(主要成分MnO2,含少量Al2O3和SiO2)、黄铁矿(FeS2)。生产MnSO4的工艺流程如下:
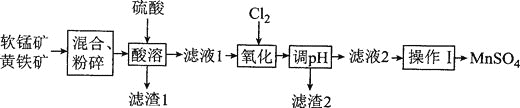
①软锰矿和黄铁矿需按一定比例混合,若黄铁矿过量太多,将导致的主要后果为________。
②“酸溶”时,黄铁矿被氧化为Fe3+、SO42-的离子方程式为________,该操作需控制在90℃,温度不能过低的原因为________。
③若使“氧化”的溶液中杂质离子除净,“调pH”应不小于________![]() 保留两位有效数字
保留两位有效数字![]() 。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
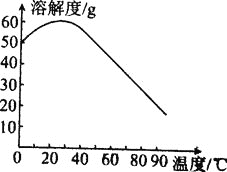
④MnSO4的溶解度曲线如图所示,则“操作I”,为________、________、用热水洗涤、干燥。
⑶用(NH4)2S2O8溶液鉴别溶液中Mn2+的现象为溶液变为紫红色。所发生反应中氧化剂和还原剂的物质的量之比为________。S2O82-中含有1个过氧键。则其中S元素的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )

A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
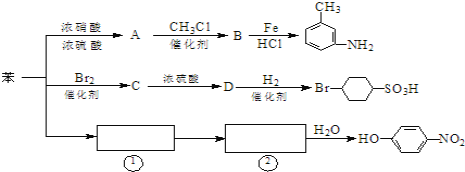
(1)A转化为B的化学方程式是____________________
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:①____,②_____
(3)有机物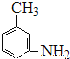 的所有原子___________(填“是”或“不是”)在同一平面上。
的所有原子___________(填“是”或“不是”)在同一平面上。
(4)有机物B苯环上的二氯代物有_____________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中各装置的叙述正确的是( )
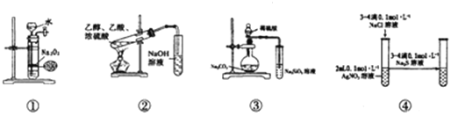
A.装置①可制备少量氧气
B.装置②可用于实验室制取和收集乙酸乙酯
C.装置③的实验可推断硫、碳、硅三种元素的非金属强弱
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
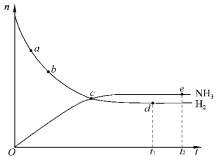
A. 点a的正反应速率比点b的小
B. 点c处正反应速率和逆反应速率相等
C. 点d (t1时刻) 和点 e (t2时刻) 处n(N2)相同
D. 在t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为2L的恒容密闭容器中,某一反应中![]() 、
、![]() 、
、![]() 三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
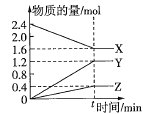
A.反应的化学方程式为![]()
B.t时刻,正、逆反应都不再继续进行,反应达到化学平衡
C.若![]() ,则0~tmin内
,则0~tmin内![]() 的化学反应速率为
的化学反应速率为![]()
D.温度、体积不变,在tmin时充入![]()
![]() 使压强增大,正、逆反应速率都增大
使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物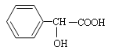 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
A.6 种B.9 种C.15 种D.19 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com