

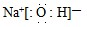 ;
;分析 常温常压下A为无色无味液体,为H2O;
B、C、G属于金属单质,化合物F的焰色反应为黄色火焰,常温下0.1mol•L-1的F溶液pH=13,含有Na元素,则C为Na,E为H2、F为NaOH,D为黑色有磁性的氧化物为Fe3O4,所以B为Fe,F和D都能和金属G反应,则G为Al,H为Al2O3、I是NaAlO2,结合题目分析解答.
解答 解:常温常压下A为无色无味液体,为H2O;B、C、G属于金属单质,化合物F的焰色反应为黄色火焰,常温下0.1mol•L-1的F溶液pH=13,含有Na元素,则C为Na,E为H2、F为NaOH,D为黑色有磁性的氧化物为Fe3O4,所以B为Fe,F和D都能和金属G反应,则G为Al,H为Al2O3、I是NaAlO2,
(1)通过以上分析知,F为NaOH,其电子式为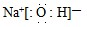 ,故答案为:
,故答案为: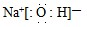 ;
;
(2)G是Al,位于第三周期第IIIA族,故答案为:第三周期第ⅢA族;
(3)①为铁和水蒸气的反应,生成四氧化三铁和氢气,反应方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
(4)反应⑤为氧化铝和NaOH溶液的反应,生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)Fe、Al、NaOH溶液构成原电池,Al作负极、Fe作正极,负极上Al失电子和氢氧根离子反应生成偏铝酸根离子和水,电极反应式为Al-3e-+4OH-═AlO2-+2H2O,故答案为:Al-3e-+4OH-═AlO2-+2H2O.
点评 本题考查无机物推断,为高频考点,涉及Al、Na、Fe及其化合物之间的转化,明确金属及其化合物特殊性质是解本题关键,易错点是(5)题电极反应式的书写,很多同学易形成Al失电子生成铝离子,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol•L-1 | |
| B. | 饱和氯水中:c(Cl-)=c(ClO-)+c(HClO) | |
| C. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | C12+H2O=HC1+HC1O | ||
| C. | 2F2+2H2O=4HF+O2 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
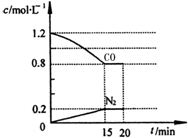 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.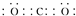 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950mL 111.2g | B. | 1000mL 117g | C. | 1000mL 111.2g | D. | 950mL 117g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
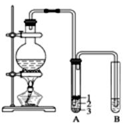 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2(g)+B2(g)?2AB(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | W(g)?Z(g)△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 在含有浓度均为0.001 mol•L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com