
分析 ①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液;
③计算消耗NH4SCN的物质的量,根据Ag++SCN-=AgSCN↓可求得硝酸银的质量,进而确定质量分数.
解答 解:①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,所以滴定终点的实验现象为:溶液变为(血)红色,
故答案为:溶液变为(血)红色;
③NH4SCN标准溶液的平均体积为29.00mL,则NH4SCN的物质的量为0.1000mol•L-1×0.029L=2.9×10-3 mol,根据Ag++SCN-=AgSCN↓可知硝酸银的质量为2.9×10-3 mol×170g/mol×$\frac{100ml}{25ml}$=1.972g所以硝酸银的质量分数为$\frac{1.972g}{2.000g}$×100%=98.60%,
故答案为:98.60%.
点评 本题考查化学反应的计算,物质含量测定,沉淀滴定原理应用等,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:实验题
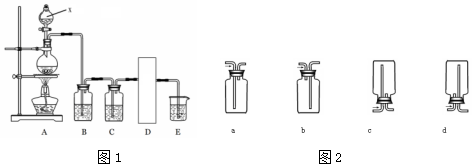
 MnCl2+Cl2↑+2H2O.
MnCl2+Cl2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)
(1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
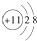 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| B. | 对2SO2+O2?2SO3△H<0的反应,使用催化剂可加快反应的速率 | |
| C. | 实验室可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,500℃左右比室温更有利于合成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 标准状况下,lmol H2所占体积约为22.4L,lmol H2和N2混合气体的体积也约为22.4L | |
| C. | 0.1L0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA | |
| D. | 2.3gNa在足量O2中燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属或非金属 | 钠 | 铝 | 铁 | 硅 | 硫 |
| 熔点/℃ | 97.8 | 660.4 | 1535 | 1410 | 112.8 |
| 沸点/℃ | 883 | 2467 | 2750 | 2353 | 444.6 |
| A. | 铝与硅 | B. | 铝与硫 | C. | 钠与硫 | D. | 钠与硅 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是
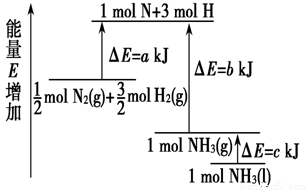
A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
D.1/2N2(g)+3/2H2(g)=NH3(g);△H=(a+b)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com