
分析 (1)根据铬的核外电子排布规律可知,铬在最外层是N层,有2个电子,据此答题;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素;
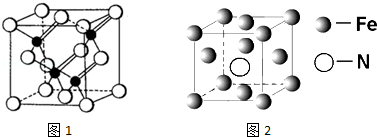
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由四个As原子形成的四面体的体心,据此判断;
(4)与As同主族的短周期元素是N、P,所经AsH3的结构应与NH3相似,NH3分子之间有氢键,沸点较高;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,进而确定氮化铁的化学式,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)铬的核外电子排布式为1s22s22p63s23p63d54s1,所以铬在最外层是N层,有1个电子,N层上原子轨道为spdf四种,共有轨道数为1+3+5+7=16,
故答案为:N;16;1;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素,30Zn的4s能级有2个电子,处于全满状态,较稳定,所以30Zn与31Ga的第一电离能不符合逐渐增大的规律,
故答案为:C;
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由四个As原子形成的四面体的体心,所以每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体,
故答案为:4;正四面体;
(4)氨分子中氮原子按sp3方式杂化,N与As同主族,所经AsH3的结构应与NH3相似,AsH3中心原子杂化的类型为sp3,NH3分子之间有氢键,沸点较高,所以一定压强下将AsH3和NH3.PH3的混合气体降温是首先液化的是NH3,
故答案为:sp3;NH3;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以氮化铁的化学式Fe4N,晶胞的体积为a3cm3,所以ρ=$\frac{m}{V}$=$\frac{\frac{14+56×4}{{N}_{A}}}{a{\;}^{3}}$g.cm-3=$\frac{238}{N{\;}_{A}a{\;}^{3}}$g.cm-3,
故答案为:Fe4N;$\frac{238}{N{\;}_{A}a{\;}^{3}}$.
点评 本题考查较为综合,原子结构、第一电离能、晶胞的结构及晶体计算、氢键等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定.


科目:高中化学 来源: 题型:选择题
| A. | 碳碳键键长:乙烯>苯 | B. | 沸点:正戊烷>异戊烷 | ||
| C. | 相对密度: > > | D. | 水溶性:CH3CH2OH>CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
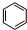 ,丁CH3CH2OH
,丁CH3CH2OH +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$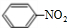 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.48L3717Cl2含有0.72NA个中子 | |
| B. | 3717Cl、3517Cl互为同位素,3717Cl2、3517Cl2互为同素异形体 | |
| C. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| D. | 3717Cl2的摩尔质量是74 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 2甲基戊烷的沸点高于己烷 | |
| D. | 用水可区分苯和溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A组 | B组 |
| Ⅰ.H-I键的键能大于H-Cl键的键能 Ⅱ.H-I键的键能小于H-Cl键的键能 Ⅲ.H-I键的键能小于H-Cl键的键能 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HCl比HI稳定 ③HI沸点比HCl低 ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com