
分析 (1)依据浓硫酸具有强的氧化性、脱水性、吸水性、酸性解答;
(2)根据同位素、同分异构体的定义判断;利用排列组合判断三原子化合物种类;
(3)若气体能完全溶于水,即NO、NO2、O2三种气体恰好完全反应,全部生成了硝酸,根据反应中电子得失守恒,应该有n(NO)×3+n(NO2)=n(O2)×4,根据气体的体积之比等于物质的量之比来计算回答.
解答 解:(1)①浓硫酸具有强的氧化性,常温下使铁、铝钝化,在工业上可用铁制槽车或铝制槽车运输浓硫酸;
故答案为:强氧化性;
②浓硫酸具有脱水性,加入蔗糖中搅拌得到黑色固体;
故答案为:脱水性;
③实验室用锌粒和稀H2SO4反应制备氢气,反应中氢离子浓度降低,体现硫酸的酸性;
故答案为:酸性;
④Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,体现浓硫酸的强氧化性和酸性,反应后在试管底部析出有灰白色固体,是因为浓硫酸具有吸水性,使五水硫酸铜失去结晶水生成无水硫酸铜;
故答案为:强氧化性、酸性、吸水性;
(2)同位素指同一元素的不同原子,互为同位素的是①④;同素异形体指同一元素的不同单质,互为同素异形体的是③;
水分子是由1个氧原子和2个氢原子构成,从氢的三种同位素中选两个氢原子,两个氢原子可以相同也可不同,所以有6种选法;氧原子有3种选法,所以3×6=18,
故答案为:①④;③;18;
(3)若气体能完全溶于水,即NO、NO2、O2三种气体恰好完全反应,全部生成了硝酸,假设气体的物质的量是amolNO,bmolNO2和xmolO2在反应中amolNO失去3amol电子,bmolNO2失去bmol电子,xmolO2得到4xmol电子生成HNO3,根据反应中电子得失守恒,应该有3a+b=4x成立,则a+b=4x-2a;
故答案为:4x-2a;
点评 本题为综合题,考查了浓硫酸的性质、同位素、同素异形体判断、氧化还原反应规律的应用,明确浓硫酸的性质及同位素、同素异形体概念、掌握反应中电子得失守恒是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的H2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
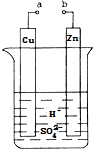 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴 加酚酞. | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞.镁带用砂纸打磨后与2mol/L盐酸反应. | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
| 探究同一周期从左到右元素 金属性的递变规律 | 探究同一主族内从上到下元素 非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
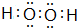 ,所含的化学键类型为共价键.
,所含的化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3molH2+2molN2 | B. | 4molNH3 | ||
| C. | 2molN2+6molH2 | D. | 1molNH3+0.5molN2+1.5molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com