
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) △H1=akJ·mol-1
2Cu+(aq) △H1=akJ·mol-1
Cl-(aq)+Cu+(aq)![]() CuCl(s) △H2=bkJ·mol-1
CuCl(s) △H2=bkJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
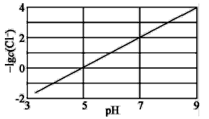
A.增加铜单质的量,有利于Cl-的去除
B.溶液pH越大,Ksp(CuCl)增大
C.反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D.![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的△H=(a+2b)kJ·mol-1
CuCl(s)的△H=(a+2b)kJ·mol-1
【答案】C
【解析】
A.铜单质为固体,其用量对化学反应速率和化学平衡没有影响,反应Cu(s)+Cu2+(aq)![]() 2Cu+(aq)的反应效果取决于Cu2+的浓度,与铜单质的量无关,故增加铜单质的量,对Cl-的去除效果没有影响,A选项错误;
2Cu+(aq)的反应效果取决于Cu2+的浓度,与铜单质的量无关,故增加铜单质的量,对Cl-的去除效果没有影响,A选项错误;
B.Ksp(CuCl)只与温度有关,与溶液pH无关,B选项错误;
C.根据Cu(s)+Cu2+(aq)![]() 2Cu+(aq),增大c(Cu2+),平衡正向移动,使得c(Cu+)增大,促进Cl-(aq)+Cu+(aq)
2Cu+(aq),增大c(Cu2+),平衡正向移动,使得c(Cu+)增大,促进Cl-(aq)+Cu+(aq)![]() CuCl(s)右移,c(Cl-)减小,C选项正确;
CuCl(s)右移,c(Cl-)减小,C选项正确;
D.①Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1,②Cl-(aq)+Cu+(aq)
2Cu+(aq) ΔH1=a kJ·mol-1,②Cl-(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1,根据盖斯定律,将①×
CuCl(s) ΔH2=b kJ·mol-1,根据盖斯定律,将①×![]() +②得:1/2Cu(s)+1/2Cu2+(aq)+Cl-(aq)
+②得:1/2Cu(s)+1/2Cu2+(aq)+Cl-(aq)![]() CuCl(s)的ΔH=(
CuCl(s)的ΔH=(![]() +b) kJ·mol-1,D选项错误;
+b) kJ·mol-1,D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素是1826年一位法国青年科学家发现的,他在研究海水制盐时向剩余的副产物(苦卤)中通入氯气后发现溶液的颜色变深,经过一步提取可得红棕色液体,有刺激性气味;B、C、D的核外电子层数不超过3个,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们的最外层电子数相等;D原子的最内层电子数是B原子核外电子数的2倍。回答下列问题:
(1)四种元素分别为A._____、B.____、C._____、D._____。
(2)A原子的电子排布式为________,D原子的原子结构示意图为______。
(3)写出由上述元素组成的单质和化合物相互作用生成沉淀的两个化学方程式________、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
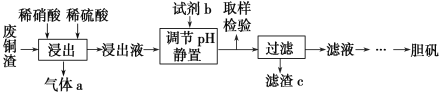
已知生成氢氧化物沉淀的pH如下表所示:
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 4.2 | 6.5 | 1.5 |
完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________。
(3)试剂b是____________,滤渣c是______________(均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、 __________________。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________。
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。
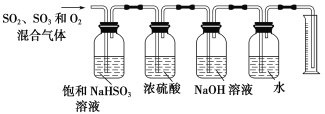
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率Al-H2O2动力电池(如图),下列说法不正确的是
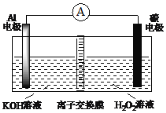
A. H2O2 在碳电极上发生还原反应
B. 碳电极附近溶液的pH增大
C. 溶液中OH-向负极移动
D. 负极反应式为Al-3e-+3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律151周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )

A.常温常压下,Y单质为固态
B.气态氢化物热稳定性:Z<W
C.原子半径:W<X
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:
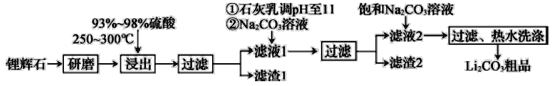
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2+H2SO4(浓)![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③某些物质的溶解度(S)如下表所示:
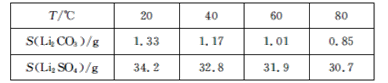
回答下列问题:
(1)从滤渣1中分离出Al2O3的流程如下所示:
![]()
写出生成沉淀的离子方程式:___。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是___(运用化学平衡原理简述)。
(3)最后一个步骤中,用“热水洗涤”的理由是___。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中电解时所用的是___(填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,LiOH溶液浓度增大的原因是___。
b中生成Li2CO3反应的化学方程式是___。
(5)磷酸亚铁锂电池总反应为FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,写出该电池放电时的正极反应:___。
LiFePO4,电池中的固体电解质可传导Li+,写出该电池放电时的正极反应:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个化学兴趣小组进行了以下探究活动:
第一组:为研究铁质材料与热浓硫酸的反应,称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。分析上述实验中SO2体积分数的结果。甲同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(1)写出产生CO2的化学方程式_____________。
(2)装置A中试剂的作用是______,反应的离子方程式________。
(3)如果气体Y中含有H2,预计实验现象应是____________。
(4)简述确认气体Y中含有CO2的实验现象__________。
第二组:拟用下列装置定量分析空气中SO2的含量:

(5)KMnO4溶液中导管末端做成球状多孔结构的作用是________。
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为___g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将漫射日光照射到装有氯气和甲烷混合气体(体积比为4∶1)的装置上(如图)。现列出如下现象,其中正确的是( )
①试管内黄绿色逐渐消失 ②试管内黄绿色加深 ③无任何现象 ④试管内液面上升 ⑤试管内壁上有油状物生成

A. ① B. ①④和⑤
C. ①和⑤ D. ②和⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com