
下列物质熔沸点高低的比较,正确的是( )
|
| A. | HF>HI | B. | CCl4<CF4 | C. | SiO2<CO2 | D. | NaCl<KCl |
考点:
晶体的类型与物质熔点、硬度、导电性等的关系.
分析:
分子晶体中熔沸点与其相对分子质量成正比,含有氢键的熔沸点较高;熔沸点原子晶体>离子晶体>分子晶体,离子晶体中熔沸点与晶格能成正比,晶格能与离子电荷成正比、与离子半径成反比,据此分析解答.
解答:
解:A.HF、HI都是分子晶体,但HF中含有氢键,所以熔沸点HF>HI,故A正确;
B.四氯化碳和四氟化碳都是分子晶体,且相对分子质量四氯化碳较大,所以熔沸点CCl4>CF4,故B错误;
C.二氧化硅是原子晶体、二氧化碳是分子晶体,所以熔沸点SiO2>CO2,故C错误;
D.氯化钠和氯化钾都是离子晶体,钠离子半径小于钾离子,所以晶格能氯化钠大于氯化钾,则熔沸点NaCl>KCl,故D错误;
故选A.
点评:
本题考查晶体熔沸点高低判断,侧重考查学生分析判断能力,明确熔沸点与晶体类型、相对分子质量、晶格能、键长、氢键之间的关系即可解答,题目难度不大.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中, Ag+浓度大小顺序正确的是 (
 )
)
A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI
C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
由1﹣溴丁烷为主要原料制取1,2﹣二溴丁烷时,发生的反应依次为( )
A.消去反应、加成反应 B.加成反应,消去反应
C.取代反应、加成反应 D.加成反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸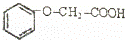 发生酯化反应的产物.
发生酯化反应的产物.
(1)化合物甲中一定含有的含氧官能团的名称为 .
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 .
(3)苯氧乙酸有多种同分异构体,同时满足条件:
①含有酯基;
②能与FeCl3溶液发生显色反应;
③含有苯环,且苯环上一硝基取代物只有两种.符合上述条件的同分异构体有 种,写出其中一种的结构简式、、(其中之一).
(4)已知:
R﹣CH2﹣COOH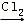
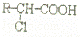
R﹣ONa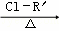 R﹣O﹣R′(R﹣、R′﹣代表烃基)
R﹣O﹣R′(R﹣、R′﹣代表烃基)
菠萝酯的合成路线如下(合成路线中的“甲”已由上述第二问推得):
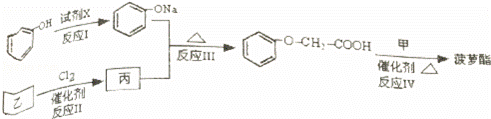
①试剂X不可选用的是(选填字母) .
a.CH3COONa溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是ClCH2COOH,反应Ⅲ的反应类型是 .
③反应Ⅳ的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是( )
|
| A. | 两原子之间形成共价键时,可形成2个σ键 |
|
| B. | 将铁制品做炊具,金属键没有被破坏 |
|
| C. | 温度越高,金属的导电性越好 |
|
| D. | 任何晶体都含化学键. |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于N2(g)+3H2(g) 2NH3(g),不能作为反应达到平衡状态的判断依据是( )
2NH3(g),不能作为反应达到平衡状态的判断依据是( )
A.恒容密闭容器中总压强不变 B.恒容密闭容器中混合气体的密度不变
C.生成氨气的速率与氨气分解的速率相等 D.N2、H2、NH3的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Na2CO3、H2SO4、Ba(OH)2三种物质的物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )
A.一定呈酸性 B.可能呈碱性 C.可能呈中性 D.一定呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com