
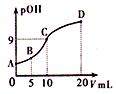
 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )| A. | 甲胺在水中的电离方程式为:CH3NH2•H2O═CH3NH3++OH- | |
| B. | A、B、C三点溶液中,水电离出来的c(H+):B>C>A | |
| C. | C点所在溶液中$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{H}_{3}^{+})}$=2.5×10-5 | |
| D. | B点溶液中存在c(CH3NH2•H2O)>c(CH3NH3+)>c(H+)>c(OH-) |
分析 A.CH3NH2•H2O也是一元弱碱,可以电离出氢氧根离子;
B.用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液滴入10ml恰好完全反应此时生成的是起始弱碱盐,溶质水解溶液显碱性,促进水的电离;
C.C点所在溶液中POH=9,氢氧根离子浓度c(OH-)=10-9mol/L,$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{{H}_{3}}^{+})c(O{H}^{-})}$=$\frac{1}{K}$;
D.B点溶液中是等浓度的CH3NH2•H2O和CH3NH3+,溶液显酸性说明电离大于离子的水解;
解答 解:A.CH3NH2•H2O也是一元弱碱,可以电离出氢氧根离子,电离过程为可逆,电离方程式为:CH3NH2•H2O?CH3NH3++OH-,故A错误;
B.用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液滴入10ml恰好完全反应此时生成的是起始弱碱盐,溶质水解溶液显碱性,促进水的电离,AB点溶液中弱碱过量抑制水的电离,所以A、B、C三点溶液中,水电离出来的c(H+):C>B>A,故B错误;
C.C点所在溶液中POH=9,氢氧根离子浓度c(OH-)=10-9mol/L,$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{{H}_{3}}^{+})c(O{H}^{-})}$=$\frac{1}{K}$,$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{{H}_{3}}^{+})}$=$\frac{1{0}^{-9}}{4×1{0}^{-5}}$=2.5×10-5,故C正确;
D.B点溶液中是反应后得到等浓度的CH3NH2•H2O和CH3NH3+,溶液显酸性说明电离大于离子的水解,溶液中存在c(CH3NH3+)>c(CH3NH2•H2O)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查了弱电解质电离平衡、酸碱反应后溶液酸碱性判断、水电离平衡影响因素、盐类水解等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | |
| B. | 生成1 mol N2有3 mol电子转移 | |
| C. | 发生氧化反应与还原反应的分子个数比是2:3 | |
| D. | 该反应利用了Cl2的强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | NaHCO3溶液中,c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-) | |
| B. | 将amol•L-1HCN溶液与amol•L-1NaOH溶液等体积混合后,测得所得溶液显碱性,则c(CN-)>c(Na+) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1.0 mol•L-1Na2CO3溶液:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
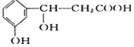 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
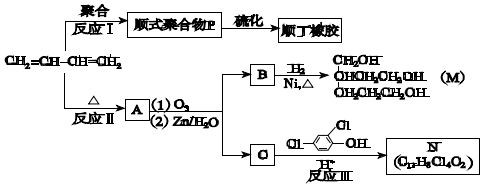
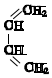 +
+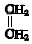 $\stackrel{△}{→}$
$\stackrel{△}{→}$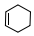
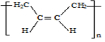 ;
;
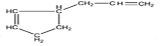
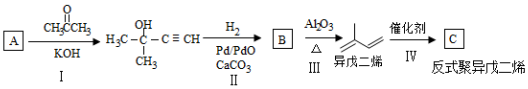
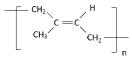 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当2a=b时,溶液中生成的沉淀质量最大 | |
| B. | 当a=2b时,发生的离子反应为2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O | |
| C. | 当2b≤3a时,发生的离子反应为3SO42-+2Al3++3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 当2a<b≤2.5a时,溶液中的n(AlO2-)为0.02(b-2a) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子数目前者大于后者 | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com